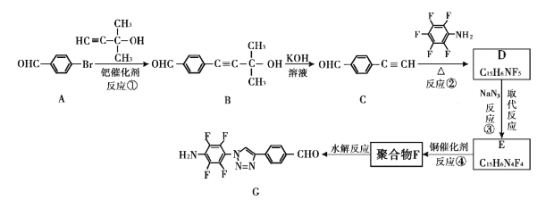
题目内容
【题目】在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.平衡后升高温度,容器中气体颜色加深
B.每消耗44.8 LNO2,生成N2O4的分子数一定为NA
C.该容器中气体质量为46 g时,原子总数为3NA
D.若N2O4分子数增加0.5NA,则放出0.5a kJ的热量
【答案】B
【解析】
A. 升高温度,化学平衡向吸热的逆反应方向移动,c(NO2)增大,使容器中气体颜色加深,A正确;
B. 由于未指明反应的温度、压强,因此不能根据气体体积确定气体的物质的量及含有的分子数目,B错误;
C. NO2、N2O4最简式是NO2,1个NO2中含有3个原子,其式量是46,所以46 g混合气体中含有NO2的物质的量是1 mol,其中含有的原子数目为3NA,C正确;
D. 根据方程式可知:每反应产生1 mol N2O4,放出a kJ的热量,若N2O4分子数增加0.5NA,产生N2O4 0.5 mol,因此放出热量为0.5a kJ,D正确;
故合理选项是B。

练习册系列答案
相关题目