题目内容
11.从2008年6月1日起,我国就禁止生产、销售、使用超薄塑料购物袋.下列对聚乙烯塑料叙述不正确的是( )| A. | 属于有机高分子材料 | B. | 大量使用会产生“白色污染” | ||
| C. | 生产原理符合“绿色化学”思想 | D. | 工业上通过乙烷加聚合成 |
分析 A.合成材料是指由人工合成的有机高分子材料制得的材料,主要包括塑料、合成纤维、合成橡胶,聚乙烯塑料属于有机高分子;
B.白色污染是人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓;
C.“绿色化学”就是要求原料物质中的所有原子完全被利用,全部转入期望的产物中,常见的反应类型有:化合反应、加成反应、加聚反应;
D.乙烷不含碳碳双键.
解答 解:A.聚乙烯塑料是人工合成的高分子材料,故A正确;
B.各类生活塑料制品使用后被弃置成为固体废物是白色污染的来源,所以聚乙烯塑料它能产生“白色污染”,故B正确;
C.乙烯合成聚乙烯是加聚反应,符合“绿色化学”思想,故C正确;
D.乙烷不含碳碳双键,不能发生加聚反应,故D错误.
故选D.
点评 本题考查了乙烯和聚乙烯,了解有关塑料、白色污染等方面的知识即可正确解答本题,题目难度不大.

练习册系列答案
相关题目
1.下列离子方程式中,正确的是( )
| A. | 向Ba(OH)2溶液中加入过量的NaHCO3溶液:HCO3-+Ba2-+OH-═BaCO3↓+H2O | |
| B. | 向小苏打溶液中加入过量石灰水,Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| C. | 向硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO4-+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
2.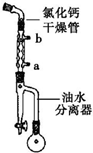 己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
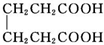 +2C2H5OH$?_{甲苯/△}^{浓硫酸}$
+2C2H5OH$?_{甲苯/△}^{浓硫酸}$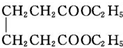 +2H2O
+2H2O
实验步骤如下:
步骤1:在50mL圆底烧瓶中加入己二酸1.8g(0.012mol),乙醇4.4mL(0.076mol),甲苯5mL和浓硫酸(1mL),装置如图所示,小火加热回流40min.
步骤2:冷却,回流装置改为蒸馏装置,常压蒸馏,在120℃左右充分蒸馏.
步骤3:将步骤2的液体倒入克氏烧瓶,进行减压蒸馏,最后得己二酸二乙酯2.2g.
(1)图中冷凝管中冷却水从a(填“a”或“b”)口进,浓硫酸的主要作用是作催化剂.
(2)回流一段时间后,打开图中旋塞,流出的物质主要是水(或水和乙醇).
(3)实验中加入过量的乙醇的目的是提高己二酸的转化率.
(4)步骤2实验已完成的标志是无馏分蒸出.
(5)本实验的产率为90.8%.
 己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下: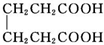 +2C2H5OH$?_{甲苯/△}^{浓硫酸}$
+2C2H5OH$?_{甲苯/△}^{浓硫酸}$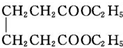 +2H2O
+2H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 己二酸二乙酯 | 202 | 1.01 | 245 | 不溶于水 |
| 己二酸 | 146 | 1.36 | 231.8 | 微溶 |
| 乙醇 | 46 | 0.79 | 78.4 | 混溶 |
| 甲苯 | 92 | 0.87 | 110.6 | 不溶于水 |
步骤1:在50mL圆底烧瓶中加入己二酸1.8g(0.012mol),乙醇4.4mL(0.076mol),甲苯5mL和浓硫酸(1mL),装置如图所示,小火加热回流40min.
步骤2:冷却,回流装置改为蒸馏装置,常压蒸馏,在120℃左右充分蒸馏.
步骤3:将步骤2的液体倒入克氏烧瓶,进行减压蒸馏,最后得己二酸二乙酯2.2g.
(1)图中冷凝管中冷却水从a(填“a”或“b”)口进,浓硫酸的主要作用是作催化剂.
(2)回流一段时间后,打开图中旋塞,流出的物质主要是水(或水和乙醇).
(3)实验中加入过量的乙醇的目的是提高己二酸的转化率.
(4)步骤2实验已完成的标志是无馏分蒸出.
(5)本实验的产率为90.8%.
19.实验测定NaHCO3溶液显碱性,下列说法中正确的是( )
| A. | 在水溶液中,HCO3-仅仅发生水解 | |
| B. | 在水溶液中,HCO3-仅仅发生电离 | |
| C. | 在水溶液中,HCO3-的水解程度要大于电离程度 | |
| D. | 在水溶液中,HCO3-的电离程度要大于水解程度 |
16.含一个双键的烯烃,与氢气加成后的产物结构简式如图,此烯烃可能有的结构有( )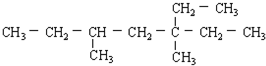
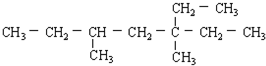
| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
3.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1 mol CO2、CO的混合气中含有的氧原子数为1.5NA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5NA | |
| C. | NA个甲烷分子和1mol甲烷的质量相等 | |
| D. | 1 mol•L-1 CuCl2溶液中含有的氯离子数为2NA |

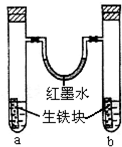 如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题:
如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题: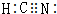 ,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.
,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.