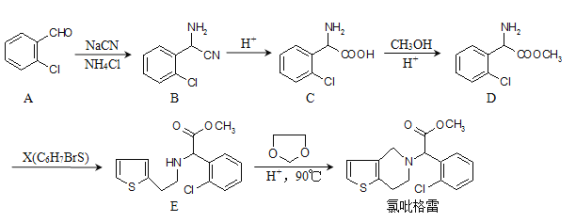
题目内容
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是___________________________________。
(2)第④步中,相关的离子方程式是_______________________________。
(3)为检验精盐纯度,需配230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_______g。
(4) 配制NaCl(精盐)溶液时需用容量瓶,其在使用前必须______ 。
(5) 配制NaCl(精盐)溶液时,若出现下列操作,其结果偏高的是__________
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀后,液面下降又加水 D.定容时俯视刻度线
(6)将已配制好的浓度为C1 mol·L-1NaCl溶液与等质量的水混合后,此时溶液的浓度为C2 mol·L-1 ,则C1 与C2二者的关系为______。
A. C1=2C2 B.C1<2C2 C.C1>2C2 D.2C1<C2
【答案】 取上层清液少许于试管中,滴加BaCl2 溶液,若没有沉淀生成,则说明已过量 CO32- +Ba2+ =BaCO3 ↓ CO32- +Ca2+ =CaCO3 ↓ 2.9 查漏 BD C
【解析】试题分析:由题意知,把粗盐溶于水后,加入稍过量的氯化钡溶液除硫酸根,再加入过量的氢氧化钠溶液除去粗盐中的镁离子,再加入稍过量的碳酸钠溶液除去过量的钡离子和粗盐中的钙离子,过滤后,向滤液中加入适量的盐酸除去过量的氢氧化钠和碳酸钠后,蒸发、结晶、烘干得到精盐。
(1)判断BaCl2已过量的方法是取上层清液少许于试管中,滴加BaCl2 溶液,若没有沉淀生成,则说明已过量。
(2)第④步中,加入碳酸钠溶液有两个作用,一是除去前面过量的氯化钡,二是除去粗盐中的氯化钙杂质,相关的离子方程式是CO32- +Ba2+ =BaCO3 ↓ 、 CO32- +Ca2+ =CaCO3 ↓。
(3)为检验精盐纯度,需配230mL0.2mol/L NaCl(精盐)溶液,由于没有230mL的容量瓶,需选择250mL的容量瓶配制250mL溶液,并且按照250mL溶液计算出所需氢化鏰的质量为2.925,则需用托盘天平称取精盐固体的质量为2.9g。
(4) 配制NaCl(精盐)溶液时需用容量瓶,其在使用前必须查漏。
(5) 配制NaCl(精盐)溶液时,若出现下列操作,A.称量时NaCl已潮解,则称量氯化钠的质量偏小,所配溶液浓度偏低; B.天平的砝码已锈蚀,则砝码质量偏大,所称量溶质质量偏大,所配溶液浓度偏高;C.定容、摇匀后,液面下降又加水,溶液体积偏大,所配溶液浓度偏低; D.定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高;其结果偏高的是BD。
(6)C1 mol·L-1NaCl溶液的密度大于水,将已配制好的浓度为C1 mol·L-1NaCl溶液与等质量的水混合后,溶液的体积大于原来的2倍,即V2>2V1,此时溶液的浓度为C2 mol·L-1 ,由于稀释前后溶质的物质的量不变,则C1V1=C2V2,C1 与C2二者的关系为C1>2C2,选C。