题目内容
(13分)X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
回答下列有关问题:
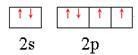
(1)W原子的外围电子排布图为_______________________________。
(2)化合物Q2W2的电子式______________,化合物XYZ的结构式________________。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是 (写分子式),原因是 。
(4)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(5)Y、W、Q三种元素所形成的常见化合物的晶体类型为 ,YW2中的化学键类型为 共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有 (要求写一种即可)。
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
(1)W原子的外围电子排布图为_______________________________。
(2)化合物Q2W2的电子式______________,化合物XYZ的结构式________________。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是 (写分子式),原因是 。
(4)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(5)Y、W、Q三种元素所形成的常见化合物的晶体类型为 ,YW2中的化学键类型为 共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有 (要求写一种即可)。
(1) (2分)(2)
(2分)(2)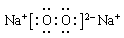 (2分)
(2分) (1分)
(1分)
(3)SO2(1分) SO2与水均为非极性分子,相似相溶(2分)
(4)120° (1分)三角锥(1分)(5)离子晶体(1分) 极性(1分) N2(1分)
 (2分)(2)
(2分)(2)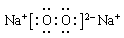 (2分)
(2分) (1分)
(1分)(3)SO2(1分) SO2与水均为非极性分子,相似相溶(2分)
(4)120° (1分)三角锥(1分)(5)离子晶体(1分) 极性(1分) N2(1分)
Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,这说明X是氢元素,Y是碳元素,Z是氮元素,W是氧元素。W与R是同族元素,所以R是硫元素。根据Q的电离能可知,第二电离能远大于第一电离能,所以Q是钠元素。
(1)W原子的外围电子排布图为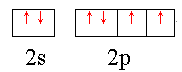
 (2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为
(2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为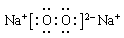 。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C N.。
。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C N.。
(3)CO2是非极性分子,SO2是极性分子,根据相似相溶原理可知,SO2易溶在极性溶剂水中。
(3)SO3分子中硫原子没有孤对电子,所以是平面三角形结构,键角是120℃的。SO32-中中心原子硫原子含有的孤对电子是(6+2-2×3)÷2=1,所以分子的立体构型是三角锥。
(5)C、O、Na三种元素形成的常见化合物是碳酸钠,属于离子晶体。CO2是共价化合物,含有风景线。电子数和原子数分别都相等的是等电子体,所以和CO互为等电子体且含有N原子的是氮气。
(1)W原子的外围电子排布图为

 (2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为
(2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为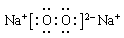 。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C N.。
。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C N.。(3)CO2是非极性分子,SO2是极性分子,根据相似相溶原理可知,SO2易溶在极性溶剂水中。
(3)SO3分子中硫原子没有孤对电子,所以是平面三角形结构,键角是120℃的。SO32-中中心原子硫原子含有的孤对电子是(6+2-2×3)÷2=1,所以分子的立体构型是三角锥。
(5)C、O、Na三种元素形成的常见化合物是碳酸钠,属于离子晶体。CO2是共价化合物,含有风景线。电子数和原子数分别都相等的是等电子体,所以和CO互为等电子体且含有N原子的是氮气。

练习册系列答案
相关题目
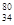 Se。下列有关该同位素的说法正确的是( )
Se。下列有关该同位素的说法正确的是( )