题目内容
根据下列热化学方程式( )
(1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol
(2)H2(g) +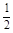 O2(g) =H2O(l) △H2=–285.8 kJ/mol
O2(g) =H2O(l) △H2=–285.8 kJ/mol
(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
(1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol
(2)H2(g) +
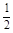 O2(g) =H2O(l) △H2=–285.8 kJ/mol
O2(g) =H2O(l) △H2=–285.8 kJ/mol(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
| A.△H=244.1kJ/mol | B.△H=-488.3kJ/mol |
| C.△H=-996.6kJ/mol | D.△H=996.6kJ/mol |
B
试题分析:根据盖斯定律可知,(1)×2+(2)×2-(3)即得到2C(s) + 2H2(g)+ O2(g)=CH3COOH(l),所以该的反应热为△H=-393.5 kJ/mol×2-285.8 kJ/mol×2+870.3kJ/mol=-488.3kJ/mol,答案选B。
点评:由于反应热和反应途径是无关系的,能量是守恒的,所以在计算反应热时1经常用到的定律就是盖斯定律。需要注意的是,反应热和化学计量数有关系,因此在扩大化学计量数时,不要忽略了反应热的变化。

练习册系列答案
相关题目
 Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0  O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1 CH3CH2OH(l) + CH3COOH(l) ;△H
CH3CH2OH(l) + CH3COOH(l) ;△H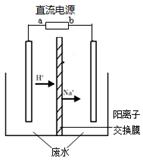
 CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1

 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2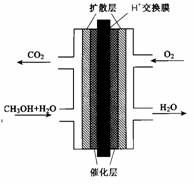
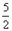 O2=2CO2(g)+H2O(l) △H=-1300kJ/mol的说法中,正确的是( )
O2=2CO2(g)+H2O(l) △H=-1300kJ/mol的说法中,正确的是( )