题目内容
根据热化学方程式:S(s) + O2(g)= SO2(g) △H =" -297.23" kJ·mol-1,下列说法正确的是:
| A.1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 |
| B.1 mol SO2(g)的能量总和小于1 mol S(s)和1 mol O2(g)的能量总和 |
| C.S(g) + O2(g) = SO2(g)△H =" -Q" kJ·mol-1;Q的值大于297.23 |
| D.S(g) + O2(g)= SO2(g)△H =" -Q" kJ·mol-1;Q的值等于297.23 |
BC
【错解分析】此题以硫的燃烧热为例,旨在考查对“热化学方程式的意义”的理解、对“燃烧热”概念的掌握和“盖斯定律”的运用,属于中等难度题。
【正解】S(s) + O2(g)= SO2(g) △H =" -297.23" kJ·mol-1是表示S的燃烧热的热化学方程式。根据“放热反应的实质是反应物的总能量高于生成物的总能量”可知,1 mol SO2(g)的能量总和小于1 mol S(s)和1 mol O2(g)的能量总和,则A项正确,B项错误;根据“盖斯定律”,S(s) + O2(g)=SO2(g)可以看作是通过“S(s)= S(g)(此过程是吸热的,设焓变为△H1,则△H1>0) ”与“S(g) + O2(g) = SO2(g)(△H =" -Q" kJ·mol-1)”两个过程实现,反应热等于两个过程的热效应的叠加,即:- 297.23 kJ·mol-1 =" -Q" kJ·mol-1+△H1,则:Q > 297.23。

练习册系列答案
相关题目

 O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1




 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ· =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·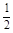 O2(g) =H2O(l) △H2=–285.8 kJ/mol
O2(g) =H2O(l) △H2=–285.8 kJ/mol