题目内容
19.相同条件下,用pH均为13的氢氧化钠和氨水,分别中和等体积、等物质的量浓度的硫酸溶液,当硫酸溶液恰好被完全中和时,消耗氢氧化钠和氨水的体积分别为Vl和V2,则Vl和V2的关系正确的是( )| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
分析 氢氧化钠和一水合氨与硫酸中和时,相同物质的量的氢氧化钠和一水合氨消耗硫酸的物质的量相同,据此分析.
解答 解:相同条件下,pH均为13的氢氧化钠和氨水,氨水的浓度大于氢氧化钠,分别中和等体积、等物质的量浓度的硫酸溶液,当硫酸溶液恰好被完全中和时,消耗氢氧化钠和氨水的体积Vl>V2,故选A.
点评 本题考查了一元强碱与一元弱碱中和硫酸的能力相同,注意相同条件下,pH均为13的氢氧化钠和氨水,氨水的浓度大于氢氧化钠,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.最近美国宇航局的科研人员确认火星地表含有溶有高氯酸盐的液态水.下列有关水及高氯酸盐的说法错误的是( )
| A. | 水是一种弱电解质 | B. | NH4ClO4溶液显酸性 | ||
| C. | NaClO4中含有离子键和共价键 | D. | NH4ClO4只有氧化性,没有还原性 |
10.下列说法正确的是( )
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 活化分子具有的能量是活化能 | |
| C. | 活化分子的总数越多,反应速率越快 | |
| D. | 单位时间内有效碰撞次数越多,反应速率越快 |
7.Na2FeO4是一种高效多功能水处理剂一种制备Na2FeO4的方法可用化学方程式表示为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应说法不正确的是( )
| A. | Na2O2在反应中既作氧化剂又作还原剂 | |
| B. | O2是氧化产物 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 2molFeSO4发生反应时,共有12mol电子转移 |
14.常温,将100mL0.001mol/L的盐酸和50mLpH=3的硫酸溶液混合,所得溶液的pH为(混合过程溶液体积的变化忽略不计)( )
| A. | 2.7 | B. | 3.0 | C. | 4.5 | D. | 3.3 |
8.已知10mL Na2R溶液含Na+的微粒数为N个,该Na2R溶液的物质的量浓度为( )
| A. | N×10-2 mol/L | B. | $\frac{N}{1.204×1{0}^{22}}$ mol/L | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol/L | D. | $\frac{N}{6.02×1{0}^{25}}$mol/L |
9.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子所以能导电 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 液态氯化氢不导电,所以氯化氢是非电解质 |
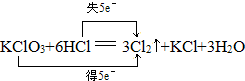 .
.