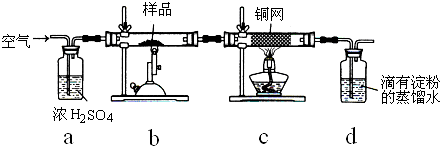
题目内容
某同学设计了如图所示的装置进行电化学实验,请你根据装置图回答相关问题:
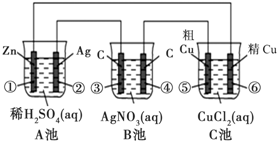
(1)C池属于什么装置
(2)电极②上发生电极反应式为
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是
(4)当电路上有0.2mol电子流过时,电极④上质量变化

(1)C池属于什么装置
电解精炼铜
电解精炼铜
.(2)电极②上发生电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
;B池中发生的总反应方程式为4AgNO3+2H2O
4Ag+4HNO3+O2↑
| ||
4AgNO3+2H2O
4Ag+4HNO3+O2↑
.
| ||
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是
C池
C池
.(4)当电路上有0.2mol电子流过时,电极④上质量变化
21.6
21.6
g,电极⑥上质量变化6.4
6.4
g.分析:依据电极材料分析A池为原电池做电源,所以B池、C池是电解池,原电池中活泼金属做负极,锌做负极发生氧化反应,电极反应为:Zn-2e-=Zn2+,银做正极发生还原反应,溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;B池是惰性电极滴加硝酸银溶液;C池是粗铜做阳极,精铜做阴极是粗铜精炼的反应原理,阳极电极反应电子守恒分别计算电极上质量变化.
解答:解:依据电极材料分析A池为原电池做电源,所以B池、C池是电解池,原电池中活泼金属做负极,锌做负极发生氧化反应,电极反应为:Zn-2e-=Zn2+,银做正极发生还原反应,溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;B池是惰性电极滴加硝酸银溶液;C池是粗铜做阳极,精铜做阴极是粗铜精炼的反应原理,阳极电极反应电子守恒分别计算电极上质量变化;
(1)分析可知C池是粗铜做阳极,精铜做阴极是粗铜精炼的反应原理,属于电解精炼铜,
故答案为:电解精炼铜;
(2)电极材料分析A池为原电池做电源,所以B池、C池是电解池,原电池中活泼金属做负极,锌做负极发生氧化反应,电极反应为:Zn-2e-=Zn2+,银做正极发生还原反应,溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;B池是惰性电极滴加硝酸银溶液,电池反应为:4AgNO3+2H2O
4Ag+4HNO3+O2↑,
故答案为:2H++2e-=H2↑;4AgNO3+2H2O
4Ag+4HNO3+O2↑;
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是C池,阳极铜失电子生成铜离子,阴极是溶液中铜离子得到电子生成铜,
故答案为:C池;
(4)当电路上有0.2mol电子流过时,电极④的电极反应为Ag++e-=Ag,电极上质量变化是增加银的质量=0.2mol×108g/mol=21.6g;电极⑥为电解池的阴极,电极反应为Cu2++2e-=Cu,电极上质量变化是增加析出铜的质量=0.1mol×64g/mol=6.4g,
故答案为:21.6;6.4.
(1)分析可知C池是粗铜做阳极,精铜做阴极是粗铜精炼的反应原理,属于电解精炼铜,
故答案为:电解精炼铜;
(2)电极材料分析A池为原电池做电源,所以B池、C池是电解池,原电池中活泼金属做负极,锌做负极发生氧化反应,电极反应为:Zn-2e-=Zn2+,银做正极发生还原反应,溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;B池是惰性电极滴加硝酸银溶液,电池反应为:4AgNO3+2H2O
| ||
故答案为:2H++2e-=H2↑;4AgNO3+2H2O
| ||
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是C池,阳极铜失电子生成铜离子,阴极是溶液中铜离子得到电子生成铜,
故答案为:C池;
(4)当电路上有0.2mol电子流过时,电极④的电极反应为Ag++e-=Ag,电极上质量变化是增加银的质量=0.2mol×108g/mol=21.6g;电极⑥为电解池的阴极,电极反应为Cu2++2e-=Cu,电极上质量变化是增加析出铜的质量=0.1mol×64g/mol=6.4g,
故答案为:21.6;6.4.
点评:本题考查了原电池、电解池原理的分析判断,电极反应书写,电子守恒计算,电极名称和反应的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
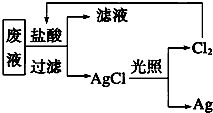 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题: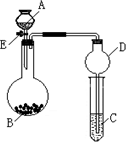 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数. (2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:
(2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答: