题目内容
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
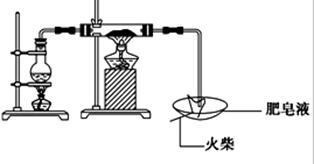
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
步骤1中加入足量1mol/L CuSO4溶液的作用是 。
(4)固体产物中铁元素的质量分数的测定可采用下图的流程
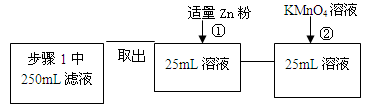
其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL。(已知5Fe2++MnO4- +8H+==5Fe3++Mn2++4H2O)
其中加入锌粉的目的是____ ____。
实验测得ag样品中固体产物铁元素的质量分数为____ __ _(只列计算表达式)。

(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
(4)固体产物中铁元素的质量分数的测定可采用下图的流程

其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL。(已知5Fe2++MnO4- +8H+==5Fe3++Mn2++4H2O)
其中加入锌粉的目的是____ ____。
实验测得ag样品中固体产物铁元素的质量分数为____ __ _(只列计算表达式)。
(1)将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱。(2分)
(2)3Fe+4H2O(g)
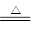 Fe3O4+4H2(2分)
Fe3O4+4H2(2分)(3)
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 3mol/L H2SO4(2分) | |
| 步骤2 | 滴加1~2滴20%KSCN(2分) | 溶液变红色,则固体产物含+3价铁(1分) |
| 步骤3 | 滴加1~2滴0.01mol/L KMnO4(2分) | 溶液紫色褪去,则固体产物含+2价铁(1分) |
除去反应后固体中可能未反应完的铁粉,以免影响后续实验的结果分析。
(4)将Fe3+还原为Fe2+ (2分)
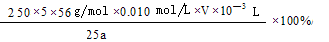 (2分)
(2分)试题分析:
(1)检查装置的气密性有加热法和液压法,从本装置的情况看,应该选用加热法,注意操作要C处将导管伸入水槽,并微热A处圆底烧瓶,现象是导管末端出现气泡,停止加热后导管末端出现一段水柱,结论是气密性良好,用操作现象结论的思维进程去答题。
(2)书写这个方程式要注意金属和水反应的特点,如常见的Na、Mg、Al、Fe等金属与水的反应。
(3)验证固体产物中铁元素的价态 ,先要将固体溶解,但考虑到可能有铁单质剩余,会和三价铁离子反应,所以要先除去铁单质,选用的试剂是硫酸铜溶液,然然,剩余的固体则应用稀硫酸溶解(因为硝酸的氧化性会氧化二价铁),接着确定检验相应离子的试剂,三价铁离子用的是硫氰化钾溶液,而检验二价铁则从限选试剂中只能用高锰酸钾溶液,利用二价铁离子的还原性,答题时注意试剂的用量和叙述即可。
(4)弄清实验目的“固体产物中铁元素的质量分数的测定”,所以由加入锌粉后溶液的黄色恰好消失,可知是用于还原三价铁离子;由题意可知,n(Fe2+)=5n(MnO4-) m(Fe)=
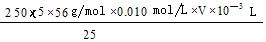 ,再求质量分数即可
,再求质量分数即可
练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目





 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)