��Ŀ����
��ѧ��ѧ�е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ��4�֣��Ҿ�����ƽ���ƶ�ԭ������ش��������⣺��������Ũ�Ⱦ�Ϊ0.1mol?L-1��������Һ����NaHCO3����Na2CO3����HCl����NH3?H2O��
��1����Һ�١��ڡ���pHֵ��С�����˳��Ϊ______��������ţ�
��2������м��������Ȼ�粒��壬��ʱc��NH4+��/c��OH-����ֵ______ �����������С�����䡱����
��3��ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL�����ʱ��Һ����ˮ�������c��H+��=______��
��4��������Һ�У�����������������Һ��Ӧ�����ܺ����ᷴӦ����Һ������Ũ���ɴ�С��˳��Ϊ______��
��5�������ۺܵ͢���Һ��Ϻ���Һǡ�ó����ԣ�����ǰ�۵����______�ܵ����������ڡ�����С�ڡ����ڡ�����
�����ܵ������ˮ��Һ�д����ܽ�ƽ�⣮�ڳ����£���Һ�и�����Ũ�������ǻ�ѧ������Ϊָ���ij˻���һ�����������ܶȻ�������Ksp��������Һ�и�����Ũ��ָ���ij˻������ܶȻ�ʱ���������������֮�����ܽ⣮��ijCuSO4��Һ��c��Cu2+��=0.02mol?L-1���������Cu��OH��2������Ӧ������ҺpH��ʹ֮����______ ����֪Ksp=2.0×10-20����
���𰸡���������1�����ж���Һ������ԣ���������ˮ��͵���ʵ�ǿ���жϣ�
��2������м��������Ȼ�粒��壬c��NH4+����������NH3?H2O�ĵ��룻
��3��ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����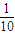 ��Ϊ0.01mol/L��
��Ϊ0.01mol/L��
��4������������������Һ��Ӧ�����ܺ����ᷴӦ��ΪNaHCO3��
��5��NH3?H2OΪ������ʣ�������ȫ���룻
�����ܶȻ����㣮
����⣺��1����NaHCO3����Na2CO3����HCl�У���Ϊ�ᣬpH��С����ˮ��̶ȱȢٴ�pH�����pHֵ��С�����˳��Ϊ�ۣ��٣��ڣ�
�ʴ�Ϊ���ۣ��٣��ڣ�
��2������м��������Ȼ�粒��壬c��NH4+����������NH3?H2O�ĵ��룬��c��OH-����С������c��NH4+��/c��OH-����ֵ���ʴ�Ϊ������
��3��ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����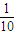 ��Ϊ0.01mol/L����Kw=c��OH-��?c��H+����֪��c��OH-��=10-12 mol?L-1�����ʱ��Һ����ˮ�������c��H+��=10-12 mol?L-1��
��Ϊ0.01mol/L����Kw=c��OH-��?c��H+����֪��c��OH-��=10-12 mol?L-1�����ʱ��Һ����ˮ�������c��H+��=10-12 mol?L-1��
�ʴ�Ϊ��10-12 mol?L-1��
��4������������������Һ��Ӧ�����ܺ����ᷴӦ��ΪNaHCO3��ˮ��ʼ��ԣ���Һ��Ӧ����c��Na+����c��HCO3-����c��OH-����c��H+����c��CO32-����
�ʴ�Ϊ��c��Na+����c��HCO3-����c��OH-����c��H+����c��CO32-����
��5��NH3?H2OΪ������ʣ�������ȫ���룬��������ϣ���Һ�����ԣ�Ҫ������ˮӦ�������ʴ�Ϊ��С�ڣ�
��c��Cu2+��×c2��OH-��=2.0×10-20����c��OH-��=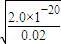 mol/L=1×10-9mol/L������pH=5��
mol/L=1×10-9mol/L������pH=5��
�ʴ�Ϊ��5��
���������⿼���Ϊ�ۺϣ��漰������ʵĵ���������ˮ���Լ����ܵ���ʵ��ܽ�ƽ������⣬�ۺϿ���ѧ���Ļ�ѧ֪ʶӦ�������ͷ�����������Ŀ�Ѷ��еȣ�
��2������м��������Ȼ�粒��壬c��NH4+����������NH3?H2O�ĵ��룻
��3��ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����
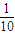 ��Ϊ0.01mol/L��
��Ϊ0.01mol/L����4������������������Һ��Ӧ�����ܺ����ᷴӦ��ΪNaHCO3��
��5��NH3?H2OΪ������ʣ�������ȫ���룻
�����ܶȻ����㣮
����⣺��1����NaHCO3����Na2CO3����HCl�У���Ϊ�ᣬpH��С����ˮ��̶ȱȢٴ�pH�����pHֵ��С�����˳��Ϊ�ۣ��٣��ڣ�
�ʴ�Ϊ���ۣ��٣��ڣ�
��2������м��������Ȼ�粒��壬c��NH4+����������NH3?H2O�ĵ��룬��c��OH-����С������c��NH4+��/c��OH-����ֵ���ʴ�Ϊ������
��3��ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����
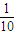 ��Ϊ0.01mol/L����Kw=c��OH-��?c��H+����֪��c��OH-��=10-12 mol?L-1�����ʱ��Һ����ˮ�������c��H+��=10-12 mol?L-1��
��Ϊ0.01mol/L����Kw=c��OH-��?c��H+����֪��c��OH-��=10-12 mol?L-1�����ʱ��Һ����ˮ�������c��H+��=10-12 mol?L-1���ʴ�Ϊ��10-12 mol?L-1��
��4������������������Һ��Ӧ�����ܺ����ᷴӦ��ΪNaHCO3��ˮ��ʼ��ԣ���Һ��Ӧ����c��Na+����c��HCO3-����c��OH-����c��H+����c��CO32-����
�ʴ�Ϊ��c��Na+����c��HCO3-����c��OH-����c��H+����c��CO32-����
��5��NH3?H2OΪ������ʣ�������ȫ���룬��������ϣ���Һ�����ԣ�Ҫ������ˮӦ�������ʴ�Ϊ��С�ڣ�
��c��Cu2+��×c2��OH-��=2.0×10-20����c��OH-��=
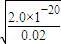 mol/L=1×10-9mol/L������pH=5��
mol/L=1×10-9mol/L������pH=5���ʴ�Ϊ��5��
���������⿼���Ϊ�ۺϣ��漰������ʵĵ���������ˮ���Լ����ܵ���ʵ��ܽ�ƽ������⣬�ۺϿ���ѧ���Ļ�ѧ֪ʶӦ�������ͷ�����������Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
 ����֪����1molB-B����167kJ������������1molB��B�ų�942kJ��������д����B4��̬���ӱ��B2��̬���ӵ��Ȼ�ѧ����ʽ��
����֪����1molB-B����167kJ������������1molB��B�ų�942kJ��������д����B4��̬���ӱ��B2��̬���ӵ��Ȼ�ѧ����ʽ��
 ����֪����1 mol B��B����167
kJ������������1 mol B��B�ų�942 kJ��������д����B4��̬���ӱ��B2��̬���ӵ��Ȼ�ѧ����ʽ��____________________________��
����֪����1 mol B��B����167
kJ������������1 mol B��B�ų�942 kJ��������д����B4��̬���ӱ��B2��̬���ӵ��Ȼ�ѧ����ʽ��____________________________�� _________________________��
_________________________��