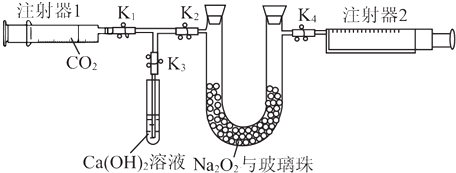
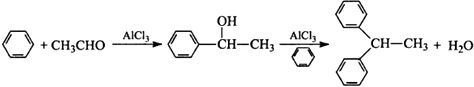
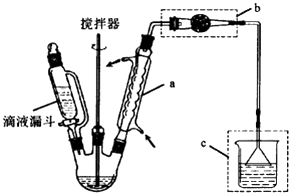
题目内容
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
【答案】D
【解析】A. 甲烷的燃烧热对应H2O(l) ,故A错误;B. 醋酸电离吸热,则CH3COOH+OH—=CH3COO—+H2O ΔH>-57.3 kJmol-1,故B错误;C. 一定条件下,该反应为可逆反应,放出热量19.3kJ时,消耗 N2小于0.5mol,H2小于1.5mol,所以其热化学方程式中N2(g)+3H2(g)![]() 2NH3(g) ΔH<-38.6 kJmol-1,故C错误;D. 由已知条件可得28g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量641.6kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1,故D正确。故选D。
2NH3(g) ΔH<-38.6 kJmol-1,故C错误;D. 由已知条件可得28g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量641.6kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1,故D正确。故选D。

【题目】在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是______,其离子的原子结构示意图为______________。
(2)元素的最高价氧化物对应的水化物中酸性最强的是____________,碱性最强的是____________,呈两性的氢氧化物是________________。
(3)按要求写出下列两种物质的电子式:①的氢化物__________________;⑨的最高价氧化物对应的水化物_______________________;
(4)在⑦与⑩的单质中,化学性质较活泼的是______,可用什么化学反应说明该事实(写出反应的化学方程式) :__________________________________。