题目内容
【题目】实验室里迅速制备少量氯气可利用以下反应:2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O 此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)用“线桥法”表示出电子转移情况:2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
______________________
(2)该反应中,氧化剂是__________,还原剂是_________。
(3) 当电子转移的数目为6.02×1023个时生成的氯气的物质的量为 _______mol
【答案】 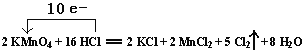 KMnO4 HCl 0.5
KMnO4 HCl 0.5
【解析】(1)反应中KMnO4中Mn元素化合价从+7价降低到+2价,得到5个电子,HCl中Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知用双线桥表示出该反应的电子转移情况为: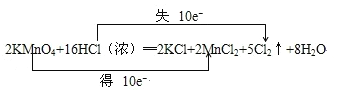 ;(2)反应中Mn的化合价由MnO4-中+7价降低为Mn2+中+2价,化合价降低,故KMnO4是氧化剂;氯元素的化合价由HCl中-1价升高为Cl2中0价,故HCl是还原剂;(3)反应中氯元素化合价由-1价升高为0价,令生成的氯气的物质的量为xmol,根据电子转移,则:xmol×2×1×6.02×1023mol-1=6.02×1023,解得x=0.5。
;(2)反应中Mn的化合价由MnO4-中+7价降低为Mn2+中+2价,化合价降低,故KMnO4是氧化剂;氯元素的化合价由HCl中-1价升高为Cl2中0价,故HCl是还原剂;(3)反应中氯元素化合价由-1价升高为0价,令生成的氯气的物质的量为xmol,根据电子转移,则:xmol×2×1×6.02×1023mol-1=6.02×1023,解得x=0.5。

【题目】有机物A是一种纯净的无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A物质18.0g,升温使其汽化,测其密度是相同条 件下H2的45倍。 | A的相对分子质量为____ |
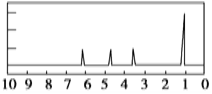
(2)A的核磁共振氢谱如下图:
| A中含有____种氢原子且吸收峰面积比为____ |
(3)另取A18.0g与足量的NaHCO3粉末反应,生成0.2mol CO2,若与足量钠反应则生成0.2molH2。 | A中所含官能团名称为______________ |
(4)将此18.0gA在足量O2中充分燃烧,并使其产物依次 缓缓通过浓硫酸、碱石灰,发现两者依次增重10.8g和26.4g。 | A的分子式___________ |
(5)综上所述,A的结构简式为____ | |