题目内容
已知下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
(3)H2(g)+ O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热ΔH为
| A.+488.3 kJ/mol | B.-488.3 kJ/mol | C.-244.15 kJ/mol | D.+244.15 kJ/mol |
B
解析试题分析:根据盖斯定律,2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热ΔH=(1)×2+(3)×2-(2)=ΔH 1×2+ΔH 3×2-ΔH 2=-488.3 kJ/mol,答案选B。
考点:考查盖斯定律的应用

形成物质世界多样性的原因有:( )
①元素种类 ②同位素 ③化学键成键方式 ④同分异构现象 ⑤同素异形现象
| A.仅①②③ | B.仅②④⑤ |
| C.仅①③ | D.①②③④⑤ |
下列说法或表示方法正确的是( )
| A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 |
| B.由C(石墨)→C(金刚石) ΔH=+11.9kJ·mol-1可知,金刚石比石墨稳定 |
| C.在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1 |
| D.H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ |
在298K、100kPa时,已知: ①2H2O(g)=O2(g)+2H2(g) ΔH1
② Cl2(g)+H2(g)=2HCl(g) ΔH2 ③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.Δ H3=ΔH1+2ΔH2 | B.Δ H3=ΔH1+ΔH2 |
| C.Δ H3=ΔH1-2ΔH2 | D.Δ H3=ΔH1-ΔH2 |
探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
已知2H2(g)+O2(g)= 2H2O(l) ΔH=-569.6 kJ·mol-1, 2H2O(g)= 2H2(g)+O2(g) ΔH=+482.1 kJ·mol-1。现有1 g液态H2O,蒸发时吸收的热量是
| A.2.43 kJ | B.4.86 kJ | C.43.8 kJ | D.87.5 kJ |
化学反应A2 + B2 = 2AB的能量变化如图所示,则下列说法正确的是( )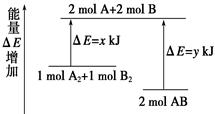
| A.该反应是吸热反应 |
| B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量 |
| C.断裂2 mol A—B键需要吸收y kJ的能量 |
| D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
下列关于化学反应与能量的说法正确的是
| A.中和反应是吸热反应 |
| B.燃烧是放热反应 |
| C.化学键断裂放出能量 |
| D.反应物总能量与生成物总能量一定相等 |
下列说法正确的是:
A.在100℃、101kPa条件下,液态水的气化热为40. 69 kJ·mol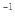 ,则 ,则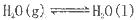  |
B.已知MgCO3的Ksp=6.82×10 ,则所有含有固体MgCO3的溶液中,都有 ,则所有含有固体MgCO3的溶液中,都有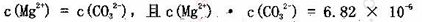 |
C.己知: 则可以计算出反应 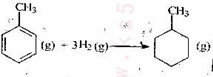  |
D.常温下,在0.10mol 的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的PH减小 的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的PH减小 |