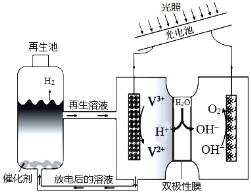
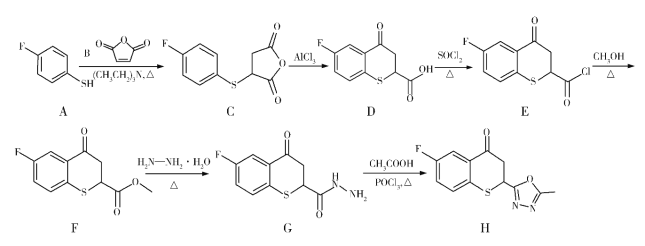
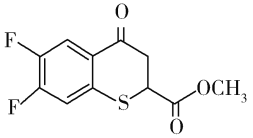
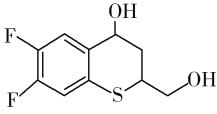
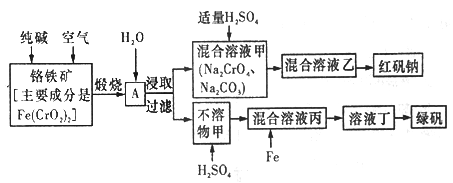
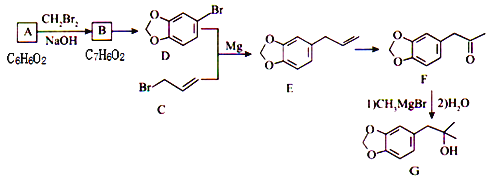
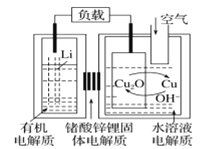
题目内容
【题目】在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是( )
A.B的转化率为20%B.平衡时A的浓度为1.50mol/L
C.x=1D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
【答案】A
【解析】
到平衡时,生成了2molC,D的物质的量为4L×0.5mol/L=2mol,则:
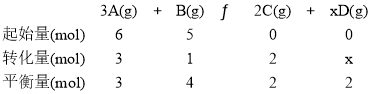
进而可计算平衡时各物质的浓度、转化率等物理量,以此解答该题。
达到平衡时,生成了2molC,D的物质的量为4L×0.5mol/L=2mol,则:
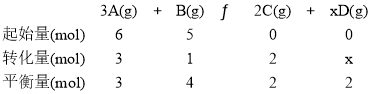
A.B的转化率为![]() ×100%=20%,故A正确;
×100%=20%,故A正确;
B.平衡时A的浓度为![]() =0.75mol/L,故B错误;
=0.75mol/L,故B错误;
C.由以上分析可知x=2,故C错误;
D.反应前后气体的物质的量不变,则压强不变,故D错误;
故答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】(15分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
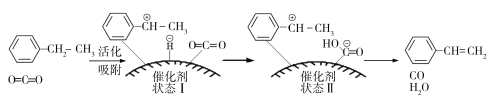
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________。