题目内容
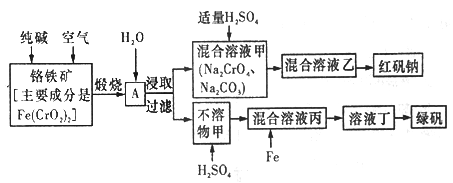
【题目】硫酸亚铁晶体俗称绿矾(FeSO4 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。
请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为______________。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2
2Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为________________。
②为了加快该反应的反应速率,可采取的措施是_________________(填一种即可)。
⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是________________。
②混合溶液乙中溶质的化学式为______________________。
(5)写出Fe与混合溶液丙反应的主要离子方程式_________________。检验溶液丁中无Fe3+的方法是:_____________。从溶液丁到绿巩的实验操作为蒸发浓缩、___________、过滤、洗涤、干燥。
【答案】 +2 价 FeO·Cr2O3 4:7 粉碎矿石(或升高温度) H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O10-2),所以H2SO4必须适量 Na2Cr2O7、Na2SO4 Fe+2Fe3+=3Fe2+ 取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+ 冷却结晶
【解析】铬铁矿中加入碳酸钠并通入氧气,高温下将Fe(CrO2)2氧化得到Fe2O3、Na2CrO4,同时生成CO2,将得到的固体溶于水得到Na2CrO4溶液,然后过滤,得到得到Na2CrO4和过量的碳酸钠混合溶液和氧化铁固体,在Na2CrO4和碳酸钠混合溶液中加入硫酸酸化,硫酸和Na2CrO4反应生成Na2Cr2O7和硫酸钠,同时除去碳酸钠,通过蒸发浓缩冷却结晶,得到红矾钠(Na2Cr2O7·2H2O);氧化铁与硫酸反应生成硫酸铁,加入铁粉将硫酸铁还原生成硫酸亚铁,最后蒸发浓缩冷却结晶,得到绿矾。
(1) Fe(CrO2)2中铬元素的化合价为+3价,根据正负化合价的代数和为0,Fe(CrO2)中铁元素的化合价为+2价,故答案为:+2 价;
(2) Fe(CrO2)2中铬元素的化合价为+3价,铁元素的化合价为+2价,可写成FeO·Cr2O3,故答案为:FeO·Cr2O3;
(3)①高温氧化时,Fe(CrO2)2和碳酸钠、氧气反应氧化还原反应生成Na2CrO4、二氧化碳和氧化铁,该反应中Fe元素化合价由+2价变为+3价、Cr元素化合价由+3价变为+6价,O元素化合价由0价变为-2价,所以氧气是氧化剂、Fe(CrO2)2是还原剂,则还原剂和氧化剂的物质的量之比为4:7,故答案为:4:7;
②根据影响化学反应速率的外界因素,为了加快该反应的反应速率,可采取的措施有粉碎矿石、升高温度等,故答案为:粉碎矿石(或升高温度);
⑷①H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O102-),所以H2SO4必须适量,故答案为:H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O102-),所以H2SO4必须适量;
②根据上述分析,混合溶液乙中的溶质有Na2Cr2O7、Na2SO4,故答案为:Na2Cr2O7、Na2SO4;
(5)Fe与硫酸铁溶液反应的离子方程式为Fe+2Fe3+=3Fe2+。检验溶液丁中无Fe3+的方法为:取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+;从硫酸亚铁溶液到绿巩的实验操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+ ;冷却结晶。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】下列选项中关于物质的性质和用途的说法均正确且有因果关系的是
选项 | 性质 | 用途 |
A | 溴化银有感光性 | 用于变色玻璃 |
B | 新制氯水显酸性 | 漂白有色布条 |
C | 浓硫酸有强氧化性 | 干燥剂 |
D | 氨气是碱性气体 | 液氨作制冷剂 |
A. A B. B C. C D. D