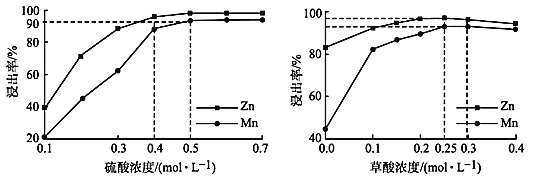
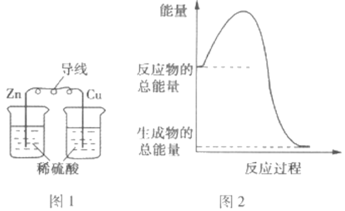
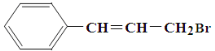��Ŀ����
����Ŀ���-ͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ��ͨ��һ�ָ��ӵ�ͭ��ʴ�D����������ܣ����зŵ����Ϊ2Li+Cu2O+H2O=2Cu+2Li++2OH������˵���������
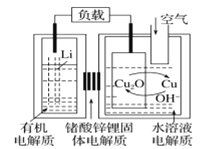
A.�ŵ�ʱ�������ĵ缫��ӦʽΪO2+2H2O+4e=4OH
B.�ŵ�ʱ��Li+���������������ƶ�
C.ͨ����ʱ��ͭ����ʴ���������Cu2O
D.������Ӧ�����У�������ΪO2
���𰸡�A
��������
A���ɵ�طŵ�����еķ���ʽΪ2Li+Cu2O+H2O=2Cu+2Li++2OH����صĸ�����ӦʽΪLi-e=Li+���ʵ�ص�������ӦʽΪCu2O+2e+H2O=2Cu+2OH��A˵������A�������⣻
B���ŵ�ʱ��Li�缫Ϊ������Cu�缫Ϊ�����������������������������������ʷŵ�ʱ��Li+��������������(ͭ�缫)�ƶ���B˵����ȷ����B���������⣻
C���ŵ�����еķ���ʽΪ2Li+Cu2O+H2O=2Cu+2Li++2OH����֪ͨ����ʱ��ͭ����ʴ���������Cu2O��C˵����ȷ����C���������⣻
D��ͨ����ʱ��ͭ����ʴ���������Cu2O���ŵ�ʱCu2Oת��ΪCu����������Ӧ�����У�Cu�൱�ڴ���������������ΪO2��D˵����ȷ����D���������⣻
��ѡ��A��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ͼ��ʾ��ʵ������ȡ�����װ�ã����з���װ����ͬ������ͼ���װ�������ף��ֱ���ͼ1��ͼ2��ʾ������ѡ������ȷ���� ( )
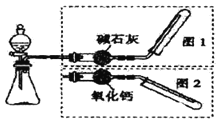
ѡ�� | ����װ���е�ҩƷ | ����ͼ���װ�� | |
A | �����������ƺ�Ũ���� | ͼ2 | |
B | ����ʯ��ϡ���� | ͼ1 | |
C | ͭ��ϡ���� | ͼ2 | |
D | �����ƺ�Ũ��ˮ | ͼ1 | |
A.AB.BC.CD.D