题目内容
(4分)一般较强酸可制取较弱酸, 这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:

(1) 请根据上述信息判断下列反应不能发生的是________(填编号)。
E.CO2+H2O+C6H5ONa―→NaHCO3+C6H5OH
(2)己知常温时Ksp(AgCl)=1.8×10-10 mol2.L-2,向50 mL 0.018 mo1.L-l的AgNO3溶液中加入相同体积0.020 mol.L-1的盐酸,则c(Ag+)= 。

(1) 请根据上述信息判断下列反应不能发生的是________(填编号)。
| A.CH3COOH+NaCN===CH3COONa+HCN |
| B.CO2+H2O+2NaClO===Na2CO3+2HClO |
| C.2HCN+Na2CO3―→2NaCN+CO2+H2O |
| D.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa |
(2)己知常温时Ksp(AgCl)=1.8×10-10 mol2.L-2,向50 mL 0.018 mo1.L-l的AgNO3溶液中加入相同体积0.020 mol.L-1的盐酸,则c(Ag+)= 。
(4分) (1) B C (2)1.8×10-7 mol/L
试题分析::(1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,则
A.CH3COOH酸性大于HCN,反应能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应不能发生,故B错误;
C.酸性H2CO3>HClO>HCN,应生成NaHCO3,不能生成CO2,故C错误;
D.酸性C6H5OH>HCO3-,反应能发生,故D正确;
E.酸性H2CO3>C6H5OH>HCO3-,反应能发生,故E正确,
故答案为:BC。
(2)向50mL 0.018mo1.L-l的AgNO3溶液中加入相同体积0.020mol.L-1的盐酸,盐酸过量,反应后的c(Cl-)=
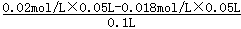 =0.001mol/L,
=0.001mol/L,则c(Ag+)=
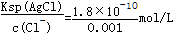 =1.8×10-7 mol/L,
=1.8×10-7 mol/L,故答案为:1.8×10-7 mol/L。
点评:本题考查较为综合,题目难度较大,易错点为(1),注意弱电解质的比较方法以及判断角度。

练习册系列答案
相关题目
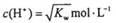 (KW为溶液所处温度时水的离子积常数)
(KW为溶液所处温度时水的离子积常数)
 >
> >
> )
)