题目内容
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MnSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:___________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() MnO(s)+CO2(g) △H1 K1
MnO(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s) △H2 K2
2MnO2(s) △H2 K2
③2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g) △H3 K3
2MnO2(s)+2CO2(g) △H3 K3
△H3=______(用△H1、△H2表示) K3=_______(用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H2______0(填“>”“<”或“=”)。
(4)在密闭容器中投入足量的MnCO3,—定条件下发生反应:MnCO3(s)![]() MnO(s)+CO2(g)
MnO(s)+CO2(g)
△H>0。在一定温度下,达到平衡状态时p(CO2)=2a MPa。
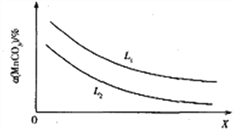
① 温度、压强对MnCO3分解率的影响如图所示:比较:L1____L2(填“>”“<”或“=”)。
② 保持温度不变,将容器体积扩大至原来的2倍,则p(CO2)的变化范围是______。
③ 保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量-定不变的是__(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)—定温度下,在容积为2L的恒容密闭容器中加人足量的MnCO3(s)和5molO2,发生反应:2MnCO(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
【答案】 ⑴ Mn2++2H2O-2e-=MnO2+4H+ ⑵ 2△H1+△H2 ![]() ·K2 ⑶ < ⑷① >
·K2 ⑶ < ⑷① >
②a MPa<p(CO2)<2a MPa ③AB ⑸ 0.5mol.L-1
【解析】(1)根据电解原理,用惰性电极电解MnSO4溶液制得MnO2的阳极为:Mn2+失电子发生氧化反应生成MnO2,其阳极电极反应式是Mn2++2H2O2e-=MnO2+4H+。
(2)由已知三个化学方程式可得:③=①×2+②,所以△H1=2△H1+△H2 、K3= K12K2 。
(3)反应②在低温条件下能自发进行,所以△H2T△S<0,根据化学方程式可看出△S<0,所以△H2<0。
(4)①根据上述MnCO3分解的化学方程式及△H>0可得:增大压强压缩体积,MnCO3分解率降低,升高温度MnCO3分解率增大,所以图中X代表压强,L1和L2代表温度,L1>L2;②保持温度不变,将容器体积扩大至原来的2倍,若平衡不移动,则p(CO2)= a MPa,而实际情况是:降低压强平衡右移,所以p(CO2)> MPa,又根据化学平衡移动原理(即勒夏特列原理)p(CO2)< 2a MPa,综上所述,a MPa <p(CO2)< 2a MPa;③ 保持温度不变,化学平衡常数不变,将容器体积压缩至原来的一半,化学平衡逆向移动,n(CO2)减小, m(MnCO3)增大,因为只有一种气体,所以c(CO2)不变。故选AB。
(5)由题意该反应达到平衡状态时c(CO2)=0.1mol L-1 min-1×10min=1 mol L-1,列三段式得:
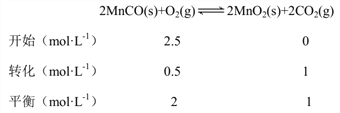
所以K=![]() =(1 mol·L-1)2 ÷ 2 mol·L-1=0.5mol.L-1
=(1 mol·L-1)2 ÷ 2 mol·L-1=0.5mol.L-1

 名校课堂系列答案
名校课堂系列答案