题目内容
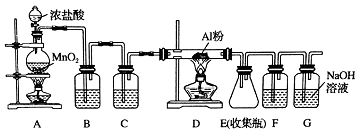
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 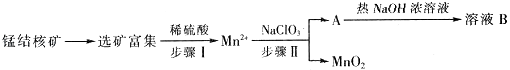
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是
【答案】
(1)5Mn2++2ClO3﹣+4H2O=5MnO2+Cl2↑+8H+
(2)氯酸钠
(3)MnO2+H2O+e﹣═MnOOH+OH﹣;0.5
(4)2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2
(5)2.7;6;Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开
【解析】解:工业上从锰结核中制取纯净的MnO2工艺流程中,先选矿富集,锰结核为锰的氧化物与其它金属氧化物的混合物,加入稀硫酸和试剂甲发生反应生成Mn2+ , 说明发生了氧化还原反应生成锰离子,则甲为还原剂,在溶液中加入NaClO3反应生成MnO2、水和气体A等,A和热氢氧化钠溶液反应生成溶液B,溶液B中的产物之一(Q)可循环用于上述生产证明Q为NaClO3 , 则A为Cl2 , B为氯化钠、氯酸钠的溶液,二氧化锰不溶于水,得到MnO2 . (1)0.1mol/L的NaClO3溶液200ml的物质的量是0.02mol,当生成0.05molMnO2时,转移电子的物质的量是0.05mol×(4﹣2)=0.1mol,根据电子得失守恒可知0.02mol氯酸钠得到0.1mol电子,因此氯元素的化合价变化5价,即从+5价降低到0价,因此还原产物是氯气,所以该反应离子方程式为2ClO3﹣+5Mn2++4H2O=5MnO2+8H++Cl2↑,所以答案是:2ClO3﹣+5Mn2++4H2O=5MnO2+8H++Cl2↑;(2)氯气与热的氢氧化钠溶液反应生成氯酸钠、氯化钠和水,因此可以循环的物质B是氯酸钠,
所以答案是:氯酸钠;(3)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e﹣=MnO(OH)+OH﹣;5分钟转移电子的电量Q=It=5A×300s=1500C,转移电子的物质的量为 ![]() =
= ![]() ≈0.0155mol,则消耗的Zn的质量为
≈0.0155mol,则消耗的Zn的质量为 ![]() ×65g/mol=0.5g;所以答案是:MnO2+H2O+e﹣═MnOOH+OH﹣;0.5g;(4)因为反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4 , 方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;根据实验室制氯气的反应原理,取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;所以答案是:2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;(5)铁加入稀H2SO4和H2O2 , 可被氧化生成Fe3+ , 铁刚好沉淀完全时离子浓度小于1×10﹣5molL﹣1 , 因Ksp=10﹣39 ,
×65g/mol=0.5g;所以答案是:MnO2+H2O+e﹣═MnOOH+OH﹣;0.5g;(4)因为反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4 , 方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;根据实验室制氯气的反应原理,取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;所以答案是:2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;(5)铁加入稀H2SO4和H2O2 , 可被氧化生成Fe3+ , 铁刚好沉淀完全时离子浓度小于1×10﹣5molL﹣1 , 因Ksp=10﹣39 ,
则c(OH﹣)= ![]() mol/L≈0.5×10﹣11mol/L,此时pH=2.7,
mol/L≈0.5×10﹣11mol/L,此时pH=2.7,
如锌开始沉淀,则c(OH﹣)= ![]() mol/L=10﹣8mol/L,此时pH=6,
mol/L=10﹣8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2 , 则Zn2+和Fe2+分离不开,
所以答案是:Fe3+;2.7;6;Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案