题目内容
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾).可用下列装置制备. 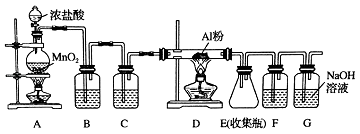
(1)装置B中盛放溶液,其作用是 . F中的是溶液,其作用是 . 用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 . 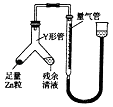
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是(填序号).
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如右图所示(夹持器具已略去).
①使Y形管中的残余清液与锌粒反应的正确操作是将转移到中.
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是(排除仪器和实验操作的影响因素).
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
【答案】
(1)饱和食盐水;除去氯化氢气体;浓硫酸;防止G中的水蒸气进入E中;碱石灰
(2)A、C、B
(3)锌粒;残余清液;气体未冷却到室温
(4)收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
【解析】解:根据实验装置图可知,该实验中用浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢、水等杂质,先用饱和食盐水除氯化氢,再用浓硫酸干燥,氯气与铝反应制得氯化铝,反应的尾气中有氯气用氢氧化钠吸收,为防止氯化铝与氢氧化钠溶液中的水蒸汽反应,所以在收集装置和尾气吸收装置之间加一干燥装置F.(1)根据所给的装置图可知,装置A是实验室利用浓盐酸与二氧化锰反应制备氯气,制得的氯气中含有氯化氢和水等杂质,所以B装置中应装饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,故F应该防止空气中的水蒸气进入E装置,所以E装置中应放浓硫酸,而G是吸收反应剩余的氯气,所以可以加入碱石灰来代替F和G的作用,
所以答案是:饱和食盐水;除去氯化氢气体;浓硫酸;防止G中的水蒸气进入E中;碱石灰;(2)装置A实验中用浓盐酸与二氧化锰反应制取氯气,应先加二氧化锰,再从分液漏斗中加入浓盐酸,再加热,所以操作顺序为ACB,
所以答案是:ACB;(3)①使Y形管中的残余清液与锌粒反应,应将锌粒加入残余清液中,其操作为将锌粒转移到残余清液中,
所以答案是:锌粒;残余清液;
②反应完毕后,每间隔1分钟读取气体体积,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变,
所以答案是:气体未冷却到室温;(4)根据ClO2沸点为10℃,熔点为﹣59℃,液体为红色,Cl2沸点为﹣34℃,液态为黄绿色,为验证Cl2中含有ClO2 , 收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化,若出现红色,则说明Cl2中含有ClO2 ,
所以答案是:收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.

 天天练口算系列答案
天天练口算系列答案【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 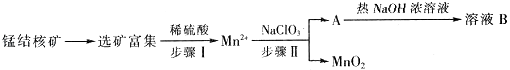
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是