题目内容
氨气是生产氮肥、硝酸、纯碱等的重要原料。
(1)实验室模拟合成氨。在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol /L),平衡时测得甲容器中H2的转化率为20%。
①平衡时甲容器中氨气的浓度为 。
②乙容器中开始反应时,v逆 v正(填<、>或=)。
③达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为 。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g) CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
①焓变ΔH_____0(填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。

③右图中的B点处,NH3的平衡转化率为 。
(1)实验室模拟合成氨。在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol /L),平衡时测得甲容器中H2的转化率为20%。
| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
①平衡时甲容器中氨气的浓度为 。
②乙容器中开始反应时,v逆 v正(填<、>或=)。
③达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为 。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)
 CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH_____0(填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
③右图中的B点处,NH3的平衡转化率为 。
(9分)(1)①0.4 mol/L(2分) ②>(1分) ③丙>甲=乙(2分)
(2) ①<(1分) ②c(NH3)增大,平衡正向移动(1分) ③32%(2分)
(2) ①<(1分) ②c(NH3)增大,平衡正向移动(1分) ③32%(2分)
试题分析:(1)①氢气的转化率是20%,则甲中消耗氢气的浓度是3mol/L×20%=0.6mol/L,则根据方程式N2+3H2
 2NH3可知,生成氨气的浓度是0.4mol/L。
2NH3可知,生成氨气的浓度是0.4mol/L。②乙容器中如果1mol/L氨气完全转化为氮气和氢气,在氮气和氢气的浓度是1mol/L和3mol/L,因此甲和乙容器是等效的。所以乙容器中平衡是氨气的浓度是0.4mol/L,小于1mol/L,因此平衡向逆反应方向进行,即v逆>v正。
③丙容器中相当于氮气和氢气的起始浓度是2mol/L和6mol/L,由于容器体积相等,所以丙容器相当于是在甲容器的基础上增大压强,平衡向生成氨气的方向移动,因此平衡时氨气的体积分数增大,则达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为丙>甲=乙。
(2)①根据表中数据可知,随着温度的升高,反应的平衡常数逐渐减小。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,则焓变ΔH<0。
②x值越大,即c(NH3)增大,促使平衡向正反应方向移动,因此CO2的转化率增大。
③根据图像可知,B点表示x=4.0,CO2的转化率是64%。设CO2的物质的量是n,则氨气的物质的量是4n。反应中消耗CO2的物质的量=0.64n,则根据方程式可知,消耗氨气的物质的量=0.64n×2=1.28n,因此氨气的转化率=
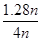 ×100%=32%。
×100%=32%。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
 3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
 2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( ) PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为 Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表: