题目内容
【题目】甲乙同学通过如下实验探究乙烯的部分化学性质。
(1)实验室制乙烯的化学方程式是__________________,乙烯使溴水褪色的化学反应类型是______________。
(2)甲同学观察到当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,此黑色物质是_________;超过170℃后生成气体速度明显加快并伴有刺激性气味气体产生,这种刺激性气味气体是_________,该气体的存在不能认为溴水褪色是乙烯的加成反应造成的,原因是(用化学方程表示):________________________。
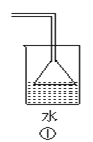
(3)乙同学经分析认为可能还有CO、CO2两种气体产生。为检验CO是否存在,他设计了如下装置。

装置a的作用是_________________,浓溴水的作用是______________,稀溴水的作用是________________。实验发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
【答案】CH3CH2OH![]() CH2=CH2↑+H2O 加成反应 C SO2 Br2+SO2+2H2O→2HBr+H2SO4 安全瓶,防倒吸 除乙烯 检验乙烯是否除尽
CH2=CH2↑+H2O 加成反应 C SO2 Br2+SO2+2H2O→2HBr+H2SO4 安全瓶,防倒吸 除乙烯 检验乙烯是否除尽
【解析】
(1)乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生的消去反应为CH3CH2OH![]() CH2=CH2↑+H2O;溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2
CH2=CH2↑+H2O;溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2![]() CH2BrCH2Br因此,本题正确答案是: CH3CH2OH
CH2BrCH2Br因此,本题正确答案是: CH3CH2OH![]() CH2=CH2↑+H2O;加成反应;
CH2=CH2↑+H2O;加成反应;
(2)由当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,可以知道浓硫酸使乙醇脱水,生成黑色的碳,同时C与浓硫酸发生氧化还原反应生成SO2,因发生Br2+SO2+2H2O→2HBr+H2SO4,则刺激性气体的存在不能认为溴水褪色是乙烯的加成反应造成的,因此,本题正确答案是:C;SO2;Br2+SO2+2H2O→2HBr+H2SO4。
(3)如图所示的装置是为了检验CO是否存在,乙烯易溶于溴水中,导致装置内的气压与外界大气压有一定的差值,设计装置a是安全瓶,可防止液体倒吸;由于二氧化碳和二氧化硫会干扰后续实验,则浓氢氧化钠的作用是除去二氧化碳和二氧化硫,浓溴水的作用是吸收产生的乙烯气体;乙烯和溴水发生加成反应,使得溴水褪色,可检验乙烯的存在,因此稀溴水的作用是验证乙烯是否除净。
答案:安全瓶,防倒吸;除乙烯;检验乙烯是否除尽。

【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ | ⑩ |
(1)写出下列元素的元素符号:① _____ ②_____ ⑩_____
(2)在这些元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是_____。
(3)这些元素的最高价氧化物对应水化物中,酸性最强的是_________;呈两性氢氧化物是__,它在水中的电离方程式为_______
(4)在⑥与⑩的单质中,化学性质较活泼的是____,因为______(用化学方程式表示)
【题目】下列是学生课外实践活动的实验设计,其中不能达到们应的实验目的的是( )
选项 | 实验目的 | 实验设计 |
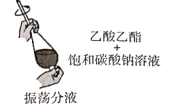
A | 除去乙酸乙酯中的乙酸 |
|
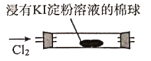
B | 证明氧化性:Cl2>I2 |
|
C | 用NaOH标准溶液滴定某稀盐酸 |
|
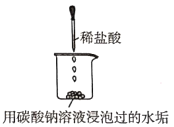
D | 探究锅炉里的水垢样品在酸中的溶解 |
|
A.AB.BC.CD.D