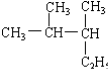
题目内容
同周期主族元素,随原子序数递增,下列说法中错误的是( )
| A、最外层电子数逐渐增多 |
| B、原子半径逐渐减小 |
| C、元素最高正化合价由+1递增到+7 |
| D、金属性逐渐减弱,非金属性逐渐增强 |
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:同一周期主族元素,随着原子序数递增,其最外层电子数逐渐增多、原子半径逐渐减小、元素最高正化合价逐渐增大(O、F元素除外)、金属性逐渐减弱但非金属性逐渐增强.
解答:
解:A.同周期主族元素,其最外层电子数从1-7,所以最外层电子数逐渐增多,故A正确;
B.同周期主族元素,核电荷数逐渐增大,则对最外层电子的吸引力逐渐增大,导致其原子半径逐渐减小,故B正确;
C.同周期主族元素,元素最高正化合价与其族序数相等,但O、F元素没有最高正化合价,所以O、F元素除外,故C错误;
D.同一周期主族元素,原子最外层电子数逐渐增多,则最外层失电子能力逐渐减小、得电子能力逐渐增大,导致元素的金属性逐渐减弱、非金属性逐渐增强,故D正确;
故选C.
B.同周期主族元素,核电荷数逐渐增大,则对最外层电子的吸引力逐渐增大,导致其原子半径逐渐减小,故B正确;
C.同周期主族元素,元素最高正化合价与其族序数相等,但O、F元素没有最高正化合价,所以O、F元素除外,故C错误;
D.同一周期主族元素,原子最外层电子数逐渐增多,则最外层失电子能力逐渐减小、得电子能力逐渐增大,导致元素的金属性逐渐减弱、非金属性逐渐增强,故D正确;
故选C.
点评:本题考查了同一周期元素的递变规律,明确出现递变规律的原因是解本题关键,熟练掌握元素周期律,灵活运用元素周期律解答问题,注意规律中的特殊现象,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、在水溶液里,乙酸分子中的-CH3可以电离出H+ |
| C、溴乙烷、乙醇在相同条件下均可发生消去反应生成乙烯 |
| D、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
下列说法中不正确的是( )
| A、天然气可以用于合成氨 |
| B、石油裂化可以提高汽油的产量 |
| C、石油裂解可以得到乙烯、丙烯等化工原料 |
| D、煤中含苯,因此可以从煤中获取苯 |
在一定容的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:4X(g)+3Y(g)?2Q(g)+nR(g).达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,则该化学方程式中的n值是( )
| A、3 | B、4 | C、5 | D、6 |
分子式为C5H10O2的有机物R在酸性条件下可水解为酸和醇,下列说法不正确的是( )
| A、这些醇和酸重新组合可形成的酯共有40种 |
| B、分子式与R相同的酸与足量碱石灰共热,最多可得到2种烷烃 |
| C、R水解得到的酸至少有5对共用电子对数目 |
| D、R水解得到的醇发生消去反应,可得到4种烯烃 |
在2L的密闭容器中,发生如下反应:3A+B?2C (A、B、C均为气体),若最初加入的A、B都是4mol,10s内用A表示的平均反应速率为0.12mol/(L?s),则10s后容器中的B的物质的量是( )
| A、2.8 mol |
| B、1.6 mol |
| C、3.2 mol |
| D、3.6 mol |
钡离子具有毒性,但在肠胃放射性检查中,却常服用“钡餐”.为减少微量溶解的钡离子对人体的伤害,“钡餐”中含有一种保护成分,其可能为( )
| A、碳酸钡 | B、硫酸钠 |
| C、稀硫酸 | D、碳酸钠 |