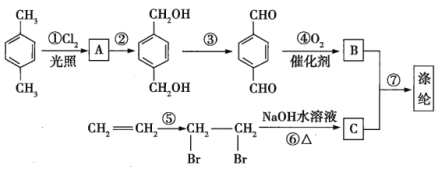
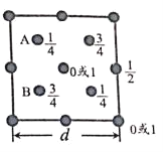
题目内容
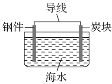
【题目】如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。
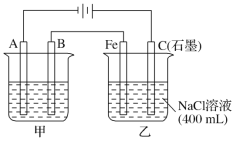
试回答下列问题:
(1)A是________极,材料是________,电极反应为_____________,B是________极,材料是________,主要电极反应为_________________,电解质溶液为________。
(2)乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈________色。
(3)常温下,若甲池中阴极增重12.8 g,则乙池中阳极放出的气体在标准状况下的体积为________。若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________,pH为________。
【答案】阴 纯铜 Cu2++2e-===Cu 阳 粗铜 Cu-2e-===Cu2+ CuSO4溶液(其他合理答案也可) 红 4.48 L 1.0 mol/L 14
【解析】
(1)依据电解精炼铜的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,据此分析解答;
(2)依据装置图,与电源正极相连的石墨电极为电解池的阳极,与电源负极连的Fe为阴极,据此分析解答;
(3)依据电极反应和电子守恒计算甲池和乙池中电极产物的物质的量,乙池中依据氢离子和氢氧根离子守恒,水的离子积常数计算得到c(OH-)和pH。
(1)电解精炼铜的原理为:粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(如CuSO4溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e-═Cu,在阳极上Cu失去电子生成铜离子,电极反应是Cu-2e-═Cu2+,故答案为:阴;精铜(或纯铜); Cu2++2e-=Cu;阳;粗铜;Cu-2e-═Cu2+;CuSO4溶液;
(2)依据装置图分析可知,与电源正极相连的石墨电极为电解池的阳极,与电源负极连接的铁电极是阴极,Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,破坏水的电离平衡,氢氧根离子浓度增大,铁电极附近滴入少量酚酞溶液,溶液变红色,故答案为:红;
③甲池中A为电解池的阴极,电极反应为Cu2++2e-═Cu,12.8g铜的物质的量为0.2mol,增重12.8 g铜转移0.4mol电子;乙池C(石墨)极为电解池的阳极,电极反应为:2Cl--2e-═Cl2↑,依据得失电子守恒,生成氯气0.2mol,放出的氯气在标况下的体积为0.2mol×22.4L/mol=4.48L,Fe电极电解反应为:2H++2e-═H2↑,消耗氢离子物质的量0.4mol,依据水的电离氢离子和氢氧根离子守恒得到,生成氢氧根离子的c(OH-)=![]() =1mol/L,溶液pH=14,故答案为:4.48L;1mol/L;14。
=1mol/L,溶液pH=14,故答案为:4.48L;1mol/L;14。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是_____。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:

①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。
),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。