题目内容
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
(1)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2 g。则10min内CO的平均反应速率为________。
(2)请用上述反应中某种气体的有关物质理量来说明该反应已达到平衡状态:
①____________________________________________________;
②____________________________________________________。
(3)写出氢氧化铝在水中发生碱式电离的电离方程式:________________;欲使上述体系中铝离子浓度增加,可加入的物质是______________________。
【答案】0.015mol/(L·min) CO[或CO2]的消耗速率和生成速率相等 CO[或CO2]的质量不再改变(其他合理答案也正确) Al(OH)3Al3++3OH- 盐酸(或其他合理答案)
【解析】
(1)根据![]() 计算反应速率;
计算反应速率;
(2)根据化学平衡的定义回答;
(3)氢氧化铝在水中发生碱式电离,电离出铝离子和氢氧根离子;根据平衡移动原理回答;
(1)在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2 g,铁的物质的量是![]() ,根据方程式Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)可知消耗CO 0.3mol,则10min内
,根据方程式Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)可知消耗CO 0.3mol,则10min内![]() 0.015mol/(L·min);
0.015mol/(L·min);
(2). 化学平衡是指在条件一定的可逆反应中,化学反应正逆反应速率相等,反应物和生成物各组分浓度不再改变的状态 ,所以CO[或CO2]的消耗速率和生成速率相等、CO[或CO2]的质量不再改变时反应达到平衡状态;
(3)氢氧化铝在水中发生碱式电离,电离出铝离子和氢氧根离子,电离方程式是Al(OH)3![]() Al3++3OH-;加入盐酸,氢氧根离子浓度降低,Al(OH)3
Al3++3OH-;加入盐酸,氢氧根离子浓度降低,Al(OH)3![]() Al3++3OH-平衡正向移动,铝离子浓度增大;
Al3++3OH-平衡正向移动,铝离子浓度增大;

【题目】环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
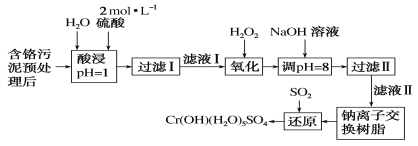
已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(1)如需配制480 mL酸浸环节所需的硫酸,需要用量筒量取18.4 mol·L-1的浓硫酸____mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器_____。
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:________。
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因_______。
(4)钠离子交换树脂的反应原理为Mn++nNaRMRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________。
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:______________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
①滴定时可选为滴定指示剂的是________(填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
②如何确定该滴定过程的终点:_______________。