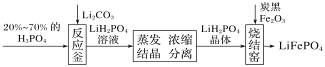
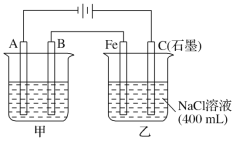
题目内容
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是_____。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
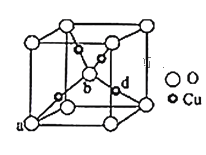
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。
),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。
【答案】第四周期Ⅷ族 X射线衍射 Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 失去第二个电子时,Cu失去的是全充满3d10电子,Fe失去的是4S1电子 ![]() HF >HCI> HBr >HI 8NH3+3Cl2=N2+6NH4Cl Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++4H2O+2OH- (
HF >HCI> HBr >HI 8NH3+3Cl2=N2+6NH4Cl Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++4H2O+2OH- (![]() ,
,![]() ,
,![]() )
) 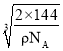
【解析】
X射线衍射可用来判断金属互化物是晶体还是非晶体。原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,推知A为H元素;B原子核外电子有6种不同的运动状态,推知B为C元素;常温下C的单质是空气中含量最多的成份,推知C为C元素;D最高价氧化物对应水化物的酸性最强,D为Cl元素;E的基态原子的最外能层只有一个电子,其他能层均已充满电子,推知E为Cu元素。
(1)①Fe在元素周期表中的位置为第四周期Ⅷ族;可用X射线衍射来判断金属互化物是晶体还是非晶体。
②由题干信息可知Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解。
③失去第二个电子时,Cu失去的是全充满3d10电子,Fe失去的是4S1电子,故I2(Cu)大于I2(Fe)。
(2)经分析可知B2A2为C2H2,碳原子间为碳碳叁键,故其电子式为![]() ;D所在主族的前四种元素分别与A形成的化合物,分别为HF 、HCI、 HBr 、HI,性质越来越稳定,故其共价键的极性由强到弱的顺序是HF >HCI> HBr >HI。
;D所在主族的前四种元素分别与A形成的化合物,分别为HF 、HCI、 HBr 、HI,性质越来越稳定,故其共价键的极性由强到弱的顺序是HF >HCI> HBr >HI。
②A和C形成的简单化合物为NH3,遇到D单质(Cl2)出现白烟,根据元素守恒推知白烟成分应为氯化铵,发生氧化还原反应,根据得失电子守恒配平得方程式:8NH3+3Cl2=N2+6NH4Cl。
③向硫酸铜溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀氢氧化铜,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,得到四氨合铜络离子,发生反应Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++4H2O+2OH-。
(3)b与周围4个d原子形成正四面体结构,b、d 与顶点的边线处于晶体对角线上, a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为(
),则d的坐标参数为(![]() ,
,![]() ,
,![]() );该晶胞中铜原子个数为4,氧原子数为8×
);该晶胞中铜原子个数为4,氧原子数为8×![]() +1=2,铜原子和氧原子个数比为2:1,故化学式为Cu2O,该化合物的摩尔质量为144g/mol,晶体密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为
+1=2,铜原子和氧原子个数比为2:1,故化学式为Cu2O,该化合物的摩尔质量为144g/mol,晶体密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为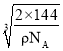 cm。
cm。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
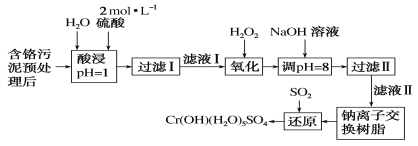
已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(1)如需配制480 mL酸浸环节所需的硫酸,需要用量筒量取18.4 mol·L-1的浓硫酸____mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器_____。
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:________。
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因_______。
(4)钠离子交换树脂的反应原理为Mn++nNaRMRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________。
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:______________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
①滴定时可选为滴定指示剂的是________(填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
②如何确定该滴定过程的终点:_______________。