题目内容
15.某河道两旁有甲、乙两厂,他们排放的工业废水中,含有K+、Cl-、OH-、Ag+、Fe3+、NO3-六种离子.(1)乙厂的废水中呈现碱性,故甲厂废水中含有的三种离子是Ag+、Fe3+、NO3-.
(2)如果往甲厂的废水中加一定量铁粉(选填“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金属是Ag.
分析 乙厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知乙厂废水中应含有K+,甲厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知甲厂还有NO3-,
由此可知:甲厂含有Ag+、Fe3+、NO3-,乙厂含有K+、Cl-、OH-,根据两厂中含有的离子组成及性质解答该题.
解答 解:(1)乙厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知乙厂废水中应含有K+,甲厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知甲厂还有NO3-,由此可知:甲厂含有Ag+、Fe3+、NO3-,故答案为:Ag+;Fe3+;NO3-;
(2)甲厂含有Ag+、Fe3+、NO3-,均不与硫酸亚铁、活性炭反应,加铁粉可置换出Ag,故答案为:铁粉;Ag.
点评 本题考查离子共存问题,为高频考点,把握习题中的隐含信息及常见离子之间的反应为解答的关键,注意判断甲乙厂废水成分的角度以及离子的性质,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
5.对如图所示有机物分子的叙述错误的是( )
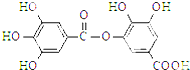

| A. | 能发生碱性水解,1 mol该有机物完全反应消耗8 mol NaOH | |
| B. | 常温下,能与Na2CO3溶液反应放出CO2 | |
| C. | 与稀硫酸共热,能生成两种有机物 | |
| D. | 该有机物的分子式为C14H10O9 |
10.根据反应式:2Fe3++2I-═2Fe2++I2,Br2+2Fe2+═2Br-+2Fe3+,可以判断微粒的氧化性从强到弱的顺序是( )
| A. | Fe3+、Br2、I2 | B. | I2、Br2、Fe3+ | C. | Br2、Fe3+、I2 | D. | Br2、I2、Fe3+ |
4.下列物质中,属于电解质的是( )
| A. | 氯化钠溶液 | B. | 二氧化碳 | C. | 氢氧化钠固体 | D. | 铁 |
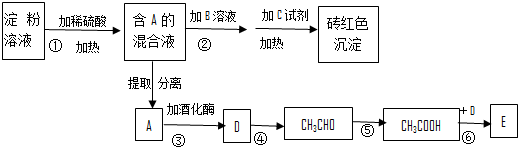
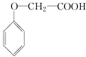 发生化学反应的产物.
发生化学反应的产物. 、
、 等.
等.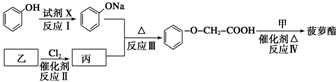
 .
.
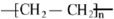 ,反应类型为加聚反应.
,反应类型为加聚反应.