题目内容
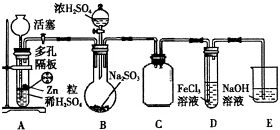
10.下列是关于Cl2的制备和性质的系列实验,请回答有关问题.(1)实验室是用二氧化锰和浓盐酸反应制氯气,其化学方程式是:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
写出该反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,指出该反应的还原剂:氯化氢.产生11.2LCl2(标准状况),转移的电子物质的量是1mol.
(2)把红热的铜丝插入已收集满氯气的集气瓶中.可观察的现象:剧烈燃烧形成了棕黄色的烟,再往瓶中加入少量的水,振荡,溶液呈蓝色.该反应的化学方程式:Cu+Cl2 $\frac{\underline{\;点燃\;}}{\;}$CuCl2,
(3)如果把干燥的氯气通入干燥的有色布条中,布条不褪色,
(4)多余的氯气要用氢氧化钠溶液吸收,写出该反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
(5)Cl2有毒,该实验应在通风橱中进行.
分析 (1)化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑结合离子方程式的书写方法解答;
分析反应中元素化合价变化,依据还原剂是指有元素化合价升高失去电子的物质判断还原剂,依据元素化合价变化数目计算转移电子数;
(2)根据铜和氯气反应的现象解答;根据氯化铜的溶液的颜色解答;铜和氯气反应生成氯化铜;
(3)氯气不具有漂白性;
(4)氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠和水;
(5)在通风橱中进行制备的气体,通常情况下有毒.
解答 解:(1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑改写成离子方程式应注意二氧化锰为氧化物、水为弱电解质、氯气为单质应保留化学式,离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
反应中氯化氢中的氯离子化合价升高,发生氧化反应,所以氯化氢为还原剂;
依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑可知:每生成1mol氯气转移2mol电子,11.2LCl2(标准状况),其物质的量为0.5mol,转移电子数为1mol;
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;氯化氢;1mol;
(2)把红热的铜丝插入已收集满氯气的集气瓶中,铜丝剧烈燃烧,形成了棕黄色的烟,发生反应Cu+Cl2 $\frac{\underline{\;点燃\;}}{\;}$CuCl2,再往瓶中加入少量的水,振荡,溶液为氯化铜溶液,呈蓝色,
故答案为:剧烈燃烧形成了棕黄色的烟;蓝色;Cu+Cl2 $\frac{\underline{\;点燃\;}}{\;}$CuCl2;
(3)氯气不具有漂白性,所以把干燥的氯气通入干燥的有色布条中,布条不褪色,故答案为:不;
(4)氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成有害的影响,所以需要在通风橱中制备,故答案为:有.
点评 本题考查了氯气的实验室制法和性质的检验,掌握氯气的性质和化学方程式的书写方法是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应中,反应物吸收环境中的热量转化为产物内部的能量 |
| A. | 反应热就是反应中放出的能量 | |
| B. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量少 | |
| D. | 由C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1可知,石墨稳定 |
| A. | O、Cl、S、P | B. | K+、Mg2+、Al3+、H+ | ||
| C. | Ca2+、Mg2+、Al3+、K+ | D. | I-、Br-、Cl-、F- |
| A. | 氢氧化钠溶液 | B. | 盐酸 | C. | 硫酸钠溶液 | D. | AgNO3溶液 |
| A. | 四氯化碳的电子式: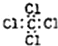 | |
| B. | CH4分子的比例模型 | |
| C. | 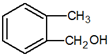 和 和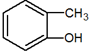 互为同系物 互为同系物 | |
| D. | 稀硝酸银溶液中滴加过量稀氨水,发生反应的离子方程式为Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
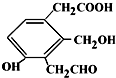 则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )
则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
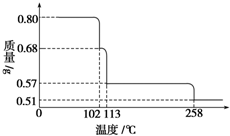 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.