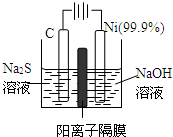
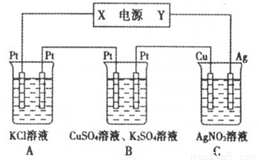
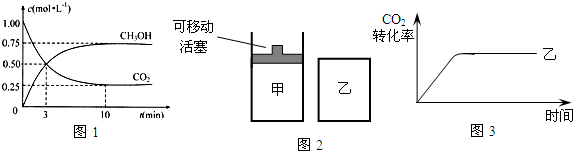
题目内容
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1∶6 B.1∶7 C.2∶11 D.16∶25
【答案】
B
【解析】
试题分析:假设产生的NO气体物质的量为1mol,则NO2、N2O4的物质的量也都为amol。由于NO2、N2O4中N的化合价相同,所以从电子转移角度可以认为是产生NO23amol. FeS与一定浓度的HNO3反应的化学方程式为:2FeS+14H++12NO3-=2Fe3++2SO42-+3NO↑+9O2↑+7H2O. 实际参加反应的FeS与HNO3的物质的量之比2:14=1:7.选项为:B.
考点:考查硝酸的氧化性的知识。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
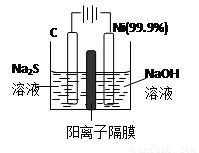
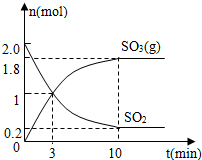 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: