题目内容
16.PM2.5微细粒子包含(NH4)2SO4、NH4NO3等.①(NH4)2SO4晶体中各种微粒间的作用力不涉及de(填序号).
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为正四面体,阴离子的中心原子轨道采用sp2杂化.
分析 ①铵盐中铵根离子和酸根离子之间存在离子键、铵根离子中存在共价键和配位键,硫酸根离子中S-O原子之间存在共价键;
②铵根离子中氮原子价层电子对个数是4且不含孤电子对,硝酸根离子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论确定离子空间构型及原子杂化方式.
解答 解:①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键,但硫酸铵中不存在范德华力和氢键,选de;
②NH4+ 的中心原子氮原子价层电子对数=$\frac{5+4-1}{2}$=4,孤电子对=$\frac{5-1×4-1}{2}$=0,所以NH4+ 的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=$\frac{5+1}{2}$=3,所以氮原子按sp2方式杂化,
故答案为:正四面体;sp2.
点评 本题考查化学键判断、微粒空间构型判断、原子杂化方式判断等知识点,为高频考点,侧重考查基本概念及知识运用能力,难点是孤电子对的计算方法,题目难度中等.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
6.下列说法中正确的是( )
| A. | 在任何状况下,1 mol CO2和1 mol H2O所含的分子数和原子数都相等 | |
| B. | 只有在标准状况下,1 mol气体所占的体积才是22.4 L | |
| C. | 某物质含有阿伏加德罗常数个微粒,该物质在标准状况下体积为22.4 L | |
| D. | 22.4 L CO所含的分子数为6.02×1023个 |
7.下列各方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | HS-+H2O?S2-+H3O+ | ||
| C. | HCO3-+OH-?CO32-+H2O | D. | CO32-+H2O?HCO3-+OH- |
11.某物质在一定条件下加热分解,产物都是气体.分解方程式为2A$\frac{\underline{\;\;△\;\;}}{\;}$B↑+2C↑+2D↑.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
| A. | 7d | B. | 5d | C. | 2.5d | D. | 2d |
1.现代建筑的门框架,常用古铜色的硬铝制造.硬铝含有的元素是( )
| A. | Al、Mg | B. | Al、Si | C. | Al、Cu、Mn、Si | D. | Al、Zn |
8.主族元素R的最高价氧化物的化学式为R2O5,则它的气态氢化物的化学式是( )
| A. | RH4 | B. | RH3 | C. | H2R | D. | HR |
19.下列各组物质中,互为同分异构体的是( )
| A. | 淀粉和纤维素 | B. | 甲酸乙酯与乙酸甲酯 | ||
| C. | 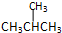 与 与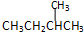 | D. |  与 与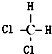 |