题目内容
【题目】(1)SO2和SO3是硫的两种氧化物,等温等压下,等质量的SO2和SO3所含分子个数比为________,氧原子个数比为________,等温等压下气体体积比_____________。
(2)100mL的某气体的质量为0.143g,该气体的相对分子质量:______________,
(3)设NA为阿伏加德罗常数的数值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积约是___________L(用含NA的式子表示)。
(4)配制100 mL1 mol/L的H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为__________mL。
(5)10.6gNa2CO3溶于水,配成500mL的溶液,溶液中溶质的物质的量________,Na+的物质的量浓度______________。
(6)标准状况下,5.6LNH3中氢原子的数目为_________________。
【答案】5:4 5:6 5:4 32 22.4bc/(aNA) 5.4 0.1mol 0.4mol/L 0.75NA
【解析】
(1)根据阿伏伽德罗定律及其推论分析;结合物质结构计算;
(2)根据M=![]() 分析计算;
分析计算;
(3)先求出其摩尔质量,然后再根据V=![]() 分析计算;
分析计算;
(4)先根据c=![]() 求出其浓度,再根据稀释定律计算;
求出其浓度,再根据稀释定律计算;
(5)利用n=![]() =cV分析作答;
=cV分析作答;
(6)根据n=![]() =
=![]() 分析计算。
分析计算。
(1)阿伏伽德罗定律及其推论可知,体积之比等于分子数之比等于物质的量之比,则等质量的SO2和SO3所含分子个数比为![]() =
=![]() =
=![]() =
=![]() =
=![]() ;SO2中含有2个氧原子,SO3中含有3个氧原子,氧原子个数比为
;SO2中含有2个氧原子,SO3中含有3个氧原子,氧原子个数比为![]() =
=![]() ;
;
(2)M=![]() =
=![]() =32g/mol,即相对分子质量为32;
=32g/mol,即相对分子质量为32;
(3)摩尔质量M=![]() =
=![]() g/mol,V=
g/mol,V=![]() =
=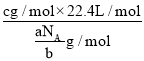 =
=![]() L;
L;
(4)c=![]() =
=![]() =18.4mol/L,V浓=
=18.4mol/L,V浓=![]() =
=![]() =0.0054L=5.4mL;
=0.0054L=5.4mL;
(5)n=![]() =
=![]() =0.1mol,c=
=0.1mol,c=![]() =
=![]() =0.2mol/L,c(Na+)=0.4mol/L;
=0.2mol/L,c(Na+)=0.4mol/L;
(6)n=![]() =
=![]() =0.25mol,氢原子的物质的量为0.25mol×3=0.75mol,氢原子的数目为0.75NA。
=0.25mol,氢原子的物质的量为0.25mol×3=0.75mol,氢原子的数目为0.75NA。