题目内容
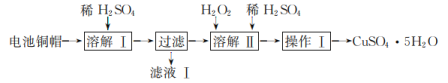
【题目】药物利伐沙班临床主要用于预防髋或膝关节置换术患者静脉血栓栓塞。药物利伐沙班的合成路线如下:
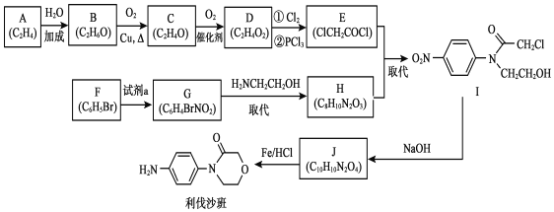
已知:R—X+![]()
![]()
![]() +HX (R代表烃基)
+HX (R代表烃基)
(1)B→C 的化学方程式是___________。
(2)C→D 的反应类型是________。
(3)F 的结构简式是_________。
(4)F→G 所需的试剂a 是____________。
(5)G→H 的化学方程式是____________。
(6)以![]() 为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。
为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。

(7)J制备利伐沙班时,J发生了还原反应,同时生成了水,则J与HCl物质的量之比为__________。
【答案】2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应 ![]() 浓HNO3、浓H2SO4
浓HNO3、浓H2SO4 ![]() +H2NCH2CH2OH
+H2NCH2CH2OH![]()
![]() +HBr
+HBr ![]()
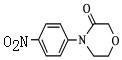 1:6
1:6
【解析】
A为CH2=CH2,和水发生加成反应生成B,B为CH3CH2OH,B发生催化氧化生成C,C为CH3CHO,C发生氧化反应生成D,D为CH3COOH,D发生取代反应生成E,E与H发生取代反应生成I,根据E、I确定H为![]() 。G发生取代反应生成H,故G为
。G发生取代反应生成H,故G为![]() ;由F分子式得F为
;由F分子式得F为![]() ,F和浓硝酸发生取代反应生成G,J发生还原反应生成利伐沙班,则J为
,F和浓硝酸发生取代反应生成G,J发生还原反应生成利伐沙班,则J为 ,I脱去1分子HCl成环得到J。
,I脱去1分子HCl成环得到J。
(1)B为CH3CH2OH,B发生催化氧化生成C为CH3CHO,B→C 的化学方程式是2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(2)C为乙醛、D为乙酸,乙醛发生催化氧化生成乙酸,C→D的反应类型是氧化反应;
故答案为:氧化反应;
(3)G为![]() ,结合F的分子式,可知F和浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成G,故F的结构简式是
,结合F的分子式,可知F和浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成G,故F的结构简式是![]() ;
;
故答案为:![]() ;
;
(4)F和浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成G,F→G所需的试剂a是浓HNO3、浓H2SO4;
故答案为:浓HNO3、浓H2SO4;
(5)G→H 的化学方程式是![]() +H2NCH2CH2OH
+H2NCH2CH2OH![]()
![]() +HBr;
+HBr;
故答案为:![]() +H2NCH2CH2OH
+H2NCH2CH2OH![]()
![]() +HBr;
+HBr;
(6)以![]() 为原料,加入ClCH2CH2OCH2COCl发生取代反应生成
为原料,加入ClCH2CH2OCH2COCl发生取代反应生成![]() ,然后发生取代反应生成
,然后发生取代反应生成 ,补充完整为:
,补充完整为: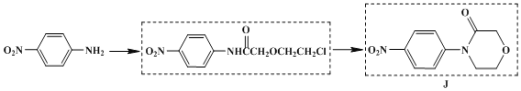 ;
;
故答案为: ;
;
(7)J制备利伐沙班时,J发生了还原反应,硝基转化为氨基,同时生成了水,1molJ 反应生成2 mol H2O,引入1mol-NH2,由H原子守恒可知需要HCl为6mol,故J与HCl物质的量之比为1:6,故答案为:1:6。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为_________________。该反应的△S ________0(选填“>”、“<”或“=”),该反应在_______条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =____________。
②工业上高炉炼铁反应的平衡常数表达式K =______,温度升高后,K值_______(选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是____________(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:_____________.
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是______;负极的电极反应是_______________。