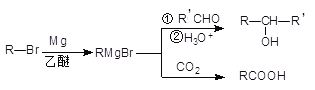
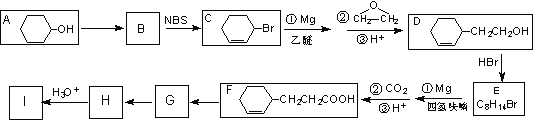
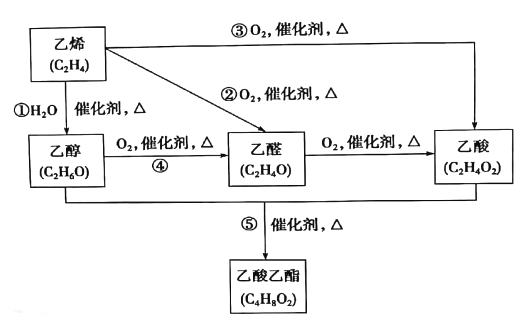
题目内容
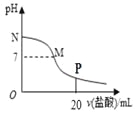
【题目】向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol·L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2 =3V1,下列说法正确的是( )
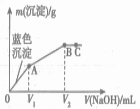
A. 原溶液中MgCl2和CuCl2的物质的量浓度相等
B. 该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小
C. 水的电离程度:A>B>C
D. 若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成
【答案】C
【解析】A. V2=3V1,说明n[Mg(OH)2]=2n[Cu(OH)2],原溶液中MgCl2和CuCl2的物质的量浓度不相等,故A错误;B.由图可知, CuCl2的物质的量浓度小且首先沉淀铜离子,说明Cu(OH)2的Ksp比Mg(OH)2的Ksp小,故B错误;C. A点时溶质为NaCl和MgCl2,B点时为NaCl,C点为NaCl和NaOH,镁离子水解促进水的电离,NaOH抑制水的电离,NaCl对水的电离无影响,故水的电离程度:A>B>C,故C正确;D. 要想生成沉淀,必须满足Qc>Ksp,因铜离子浓度大小未知,则无法判断是否生成沉淀,故D错误;答案选C。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目