题目内容
根据如图回答问题:
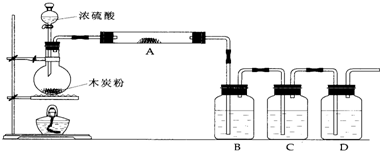
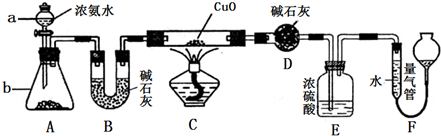
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气.
答:______
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:______
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是______,作用是______.
B中加入的试剂是______,作用是______.
C中加入的试剂是______,作用是除尽______气体.
D中加入的试剂是______,作用是______.
(4)实验时,C中应观察到的现象是______.

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气.
答:______
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:______
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是______,作用是______.
B中加入的试剂是______,作用是______.
C中加入的试剂是______,作用是除尽______气体.
D中加入的试剂是______,作用是______.
(4)实验时,C中应观察到的现象是______.
(1)由于装置较大,用手捂的方法难以观察到明显现象,可在反应前点燃酒精灯,加热烧瓶一小会儿.在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气,
故答案为:反应前点燃酒精灯,加热烧瓶一小会儿.在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气;
(2)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,反应的方程式为2H2SO4(浓)+C
CO2↑+2SO2↑+2H2O,
故答案为:2H2SO4(浓)+C
CO2↑+2SO2↑+2H2O;
(3)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,可先用无水硫酸铜检验水,然后用品红检验二氧化硫,用酸性高锰酸钾除去二氧化硫,可用澄清石灰水检验二氧化碳气体,则A中加入无水硫酸铜,目的是检验 H2O,B中加入品红溶液,目的是检验 SO2,C中加入足量酸性KMnO4 溶液,目的是除去SO2,D中加入澄清石灰水,目的是检验CO2,
故答案为:无水硫酸铜;检验H2O;
品红溶液;检验SO2;
足量酸性KMnO4溶液;SO2;
澄清石灰水;检验CO2;
(4)二氧化碳不溶液酸性高锰酸钾,二氧化硫与酸性高锰酸钾发生氧化还原反应,可被还原生成二氧化锰,则可观察到导管有气泡冒出,溶液紫色逐渐变浅,瓶底有少量黑色固体生成,
故答案为:导管有气泡冒出,溶液紫色逐渐变浅,瓶底有少量黑色固体生成.
故答案为:反应前点燃酒精灯,加热烧瓶一小会儿.在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气;
(2)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,反应的方程式为2H2SO4(浓)+C
| ||
故答案为:2H2SO4(浓)+C
| ||
(3)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,可先用无水硫酸铜检验水,然后用品红检验二氧化硫,用酸性高锰酸钾除去二氧化硫,可用澄清石灰水检验二氧化碳气体,则A中加入无水硫酸铜,目的是检验 H2O,B中加入品红溶液,目的是检验 SO2,C中加入足量酸性KMnO4 溶液,目的是除去SO2,D中加入澄清石灰水,目的是检验CO2,
故答案为:无水硫酸铜;检验H2O;
品红溶液;检验SO2;
足量酸性KMnO4溶液;SO2;
澄清石灰水;检验CO2;
(4)二氧化碳不溶液酸性高锰酸钾,二氧化硫与酸性高锰酸钾发生氧化还原反应,可被还原生成二氧化锰,则可观察到导管有气泡冒出,溶液紫色逐渐变浅,瓶底有少量黑色固体生成,
故答案为:导管有气泡冒出,溶液紫色逐渐变浅,瓶底有少量黑色固体生成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目