题目内容
【题目】(1)已知:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,测得平衡时NO2与SO2体积比为1:6,则平衡常数K=______。
(2)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列各小题:
CH3OH(g)。根据题意完成下列各小题:
①反应达到平衡时,平衡常数表达式K=______。
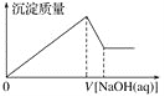
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=_____。(用图中出现的字母表示)
③甲醇—空气燃料电池是一种环境友好型碱性电池,该电池放电时,负极的反应式为_____。
④甲醇是未来的重要的能源物质,常温下,1g甲醇液体完全燃烧生成液态水时放出22.7kJ的能量,写出甲醇燃烧热的热化学方程式_____。
【答案】-41.8 2.67 ![]()
![]() mol(Lmin)-1 CH3OH+8OH--6e-=CO32-+6H2O CH3OH(l)+
mol(Lmin)-1 CH3OH+8OH--6e-=CO32-+6H2O CH3OH(l)+![]() O2(g)→CO2(g)+2H2O(l)△H=-725.76kJmol-1
O2(g)→CO2(g)+2H2O(l)△H=-725.76kJmol-1
【解析】
(1)相同状态下气体的体积比等于物质的量,反应前NO2与SO2的体积比为1:2,即物质的量之比为1:2;平衡时NO2与SO2体积比为1:6,即物质的量之比为1:6,可设初始投料为1molNO2和2molSO2,再根据三段式进行计算。
(1)已知:①2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1
②2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1
将方程式![]() 可得方程式NO2(g)+SO2(g)SO3(g)+NO(g)△H=
可得方程式NO2(g)+SO2(g)SO3(g)+NO(g)△H=![]() kJ/mol=-41.8kJ/mol;
kJ/mol=-41.8kJ/mol;
设NO2与SO2的物质的量分别是1mol、2mol,设消耗的NO2物质的量为xmol,列三段式有:
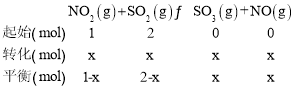
平衡时NO2与SO2体积比为1:6,即(1-x):(2-x)=1:6,x=0.8mol,则平衡时n(NO2)=0.2mol、n(SO2)=1.2mol、n(SO3)=0.8mol、n(NO)=0.8mol,因该反应前后气体系数之和相等,所以可用物质的量代替浓度进行平衡常数的计算,则平衡常数K=![]() =2.67;
=2.67;
(2)①化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=![]() ;
;
②据图可知500℃时经tbmin后反应达到平衡,平衡时△n(CH3OH)=nb mol,根据方程式可知该时间内△n(H2)=2nb mol,容器体积为3L,所以v(H2)=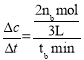 =
=![]() mol(Lmin)-1;
mol(Lmin)-1;
③放电时,负极上甲醇失电子发生氧化反应,由于电解质溶液显碱性,所以生成碳酸根,电极方程式为CH3OH+8OH--6e-=CO32-+6H2O;
④燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,1mol CH3OH的质量为32g,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则32g甲醇完全燃烧方程的热量为725.76kJ,所以甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)→CO2(g)+2H2O(l)△H=-725.76kJmol-1。
O2(g)→CO2(g)+2H2O(l)△H=-725.76kJmol-1。

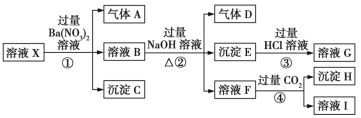
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl﹣ CO32﹣ NO3﹣ SO42﹣ SiO32﹣ |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是_____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_______。
(3)将Ⅲ中红棕色气体(标况下)收集一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为_________mol/L(精确到千分位)。
(4)甲同学最终确定原溶液中所含阳离子是___________,阴离子是_______。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为_________________,质量为_______________g。