题目内容
【题目】(多选)恒温下,容积均为2L的密闭容器M,N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g)2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3mol A、2mol B;2min达平衡,生成D 1.2mol,测得从反应开始到平衡C的速率为0.3mol(Lmin)﹣1 . N:2mol C,y mol D;达平衡时c(A)=0.6molL﹣1 . 下列推断的结论中不正确的是( )
A.x=2
B.平衡时M中c(A)<0.6 mol/L
C.y>0.8
D.M,N达到平衡时容器中各物质浓度相等
【答案】BC
【解析】解:A.从反应开始到平衡,C的速率为0.3mol(Lmin),则△n(C)=0.3mol(Lmin)×2min×2L=1.2mol,物质的量之比等于化学计量数之比,所以2:x=1.2mol:1.2mol,解得x=2,故A正确;
B.从反应开始到平衡,C的速率为0.3mol(Lmin),所以△c(C)=0.3mol(Lmin)×2min=0.6mol/L,浓度变化量之比等于化学计量数之比,所以△c(A)= ![]() △c(C)=
△c(C)= ![]() ×0.6mol/L=0.9mol/L,所以平衡时c(A)=
×0.6mol/L=0.9mol/L,所以平衡时c(A)= ![]() ﹣0.9mol/L=0.6mol/L,故B错误;
﹣0.9mol/L=0.6mol/L,故B错误;
C.由B中计算可知M中A的平衡浓度为0.6mol/L,所以M、N是等效平衡,则按化学计量数转化到左边满足n(A)=3mol,n(B)=2mol,恰好转化时y=3mol× ![]() =2mol,由于D为固体,故y≥2,故C错误;
=2mol,由于D为固体,故y≥2,故C错误;
D.B计算分析可知,M容器中,平衡时c(A)= ![]() ﹣0.9mol/L=0.6mol/L,N容器中加入2molC和2molD与M容器中达到相同的平衡状态,所以各物质浓度相同,故D正确;
﹣0.9mol/L=0.6mol/L,N容器中加入2molC和2molD与M容器中达到相同的平衡状态,所以各物质浓度相同,故D正确;
故选BC.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 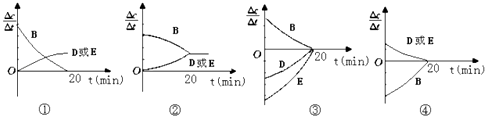
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.) 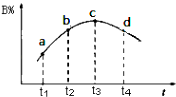
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在一定温度和压强下,CO(g)+2H2(g)CH3OH(g)△H=﹣128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).
若此时再向该容器中投入10a mol CO,20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO,H2、CH3OH的浓度之比为1:2:1
E.CH3OH,CO,H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=;a1+a3(填“<”、“>”或“=”,).



