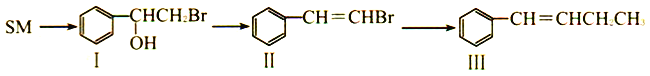��Ŀ����
����Ŀ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
(1)��ҵ�Ͽ�����CO��CO2���Ʊ����Һ��ȼ�ϼ״�����֪: 800��ʱ
��Ӧ��:2H2(g)+CO(g)![]() CH3OH(g) ��H=-90.8 kJ/mol
CH3OH(g) ��H=-90.8 kJ/mol
��Ӧ��:H2(g)+CO2(g)![]() H2O(g)+CO(g) ��H=+41.2kJ/mol
H2O(g)+CO(g) ��H=+41.2kJ/mol
(1)д����CO2��H2��Ӧ�Ʊ��״����Ȼ�ѧ����ʽ___________________________________��
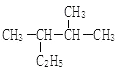
(2)���ڷ�Ӧ�٣������һ�����ܱ������а����ʵ���֮��1:2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ1��ʾ���ݴ��ж�
��ѹǿP1_____P2(�>����<����=������ͬ)
��ƽ�ⳣ��K(״̬C)_____K(״̬D)
�۷�Ӧ����:V��(״̬A)_____V��(״̬B)
(3)���ڷ�Ӧ�ڣ������һ�����ܱ������м���һ������H2��CO�����з�Ӧ������˵����ȷ����______��
A.���÷�Ӧ�ں��ݣ����ȵ������н��У���������ѹǿ���ֲ���ʱ������Ӧ�ﵽƽ��״̬
B.�÷�Ӧ�ﵽƽ��ʱ����ƽ����ϵ�г���һ�����ĺ�����ƽ����ܷ����ƶ�
C.���º��������£����ı䷴Ӧ���Ͷ��������H��ֵ�������仯
D.���º��������£���Ͷ��������������ֲ��䣬����ʼͶ�ϱ�[n(H2)/n(CO2)]=X����X=2��1/2ʱ��H2O������������䡣
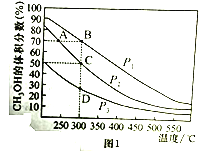
(4)���ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2������������ʱ���ڲ�ͬ����(I��II��III)�����£�CH4���������ʱ��ı仯����ͼ2��ʾ����0-15h�ڣ��Է�Ӧ��Ч����õĴ�����____________(�����)��
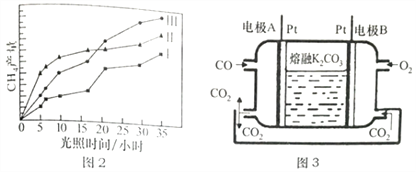
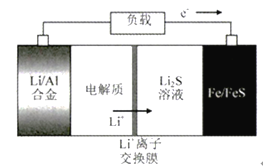
(5)һ������COȼ�ϵ�ع���ԭ������ͼ3��ʾ���õ�ظ����缫��ӦʽΪ______________���缫A��������CO2�в��ֲ���ѭ�����ã���������Ϊ______________________��
���𰸡� CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)��H=-49.6kJ/mol > = < A C D II CO+CO32--2e-=2CO2 50%
CH3OH(g)+H2O(g)��H=-49.6kJ/mol > = < A C D II CO+CO32--2e-=2CO2 50%
��������(1)��2H2(g)+CO(g)CH3OH(g) ��H=-90.8kJmol-1����H2(g)+CO2(g)H2O(g)+CO(g) ��H=+41.2kJmol-1�����ݸ�˹���ɣ���+�ڿɵã�3H2(g)+CO2(g)CH3OH(g)+H2O(g) ��H=-49.6kJ/mol���ʴ�Ϊ��3H2(g)+CO2(g)CH3OH(g)+H2O(g)��H=-49.6kJ/mol��
(2)����300��ʱ������ѹǿ��ƽ�������ƶ���CH3OH�����������������P1��P2���ʴ�Ϊ������
��ƽ�ⳣ����ѹǿ�أ�ֻ���¶��йأ�B��C��D�¶���ȣ���KB=KC=KD���ʴ�Ϊ��=��
����A��Bѹǿ���ӣ��¶����ߣ��淴Ӧ�������ӣ���v��(A)��v��(B)���ʴ�Ϊ������
(3)���ڷ�Ӧ��H2(g)+CO2(g) ![]() H2O(g)+ CO (g) ��H=+41.2kJ/mol�������һ�����ܱ������м���һ������H2��CO���з�Ӧ��
H2O(g)+ CO (g) ��H=+41.2kJ/mol�������һ�����ܱ������м���һ������H2��CO���з�Ӧ��
A.���÷�Ӧ�ں��ݣ����ȵ������н��У��÷�Ӧǰ����������ʵ������䣬�����������ѹǿʼ�ղ��䣬����Ӧ���ȣ����ŷ�Ӧ�Ľ��У������ѹǿ��С�������ֲ���ʱ˵����Ӧ�ﵽƽ��״̬����ȷ��B.�÷�Ӧ�ﵽƽ��ʱ����ƽ����ϵ�г���һ�����ĺ������÷�Ӧǰ����������ʵ������䣬ƽ�ⲻ���ܷ����ƶ�������C.���º��������£���H��ֵ���淴Ӧ���Ͷ�����仯���仯����ȷ��D. ����H2(g)+CO2(g) ![]() H2O(g)+ CO (g) ��֪�����º��������£���Ͷ��������������ֲ��䣬����ʼͶ�ϱ�[n(H2)/n(CO2)]=X����X=2��1/2ʱ��ת���������������̼����ȣ����ɵ�H2O��ȣ�ˮ������������䣬��ȷ����ѡACD��
H2O(g)+ CO (g) ��֪�����º��������£���Ͷ��������������ֲ��䣬����ʼͶ�ϱ�[n(H2)/n(CO2)]=X����X=2��1/2ʱ��ת���������������̼����ȣ����ɵ�H2O��ȣ�ˮ������������䣬��ȷ����ѡACD��
(4)��ͼ��֪��0-15Сʱ�ڣ���ͬʱ���ڵڢ��ִ������������ռ���CH4��࣬��Ӧ��Ч����õĴ����Ǣʴ�Ϊ������
(5)��������������Ӧ���缫��ӦʽΪ��CO-2e-+CO32-=2CO2�����ݸ���2CO+2CO32--4e-=4CO2����������ӦΪO2+4e-+2CO2�T2CO32-��������ת��4mol������ͬ������¸�������4mol�Ķ�����̼������������2mol�Ķ�����̼������������Ϊ50%���ʴ�Ϊ��CO-2e-+CO32-=2CO2��50%��

����Ŀ����2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K= �� ��֪��K��300�棩��K��350�棩���÷�Ӧ����Ӧ������ȡ������ȡ�����
��2��ͼ�б�ʾNO2�ı仯�������� �� ��O2��Ũ�ȱ仯��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v= �� 
��3����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� a��v��NO2��=2v��O2�� b��������ѹǿ���ֲ���
c��v����NO��=2v����O2�� d�����������ʵ��ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ����� a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ�����