题目内容
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,

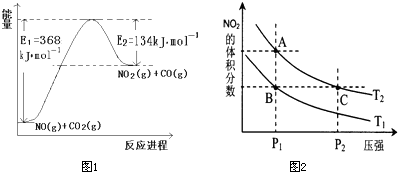
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
|
化学键 |
H-H |
N≡N |
|
键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
;△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol。
2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435 kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热 kJ/mol。
kJ/mol。
(1)N2(g)+3H2(g) 2NH3(g)
△H=-92
kJ/mol (2分)
2NH3(g)
△H=-92
kJ/mol (2分)
(2)390 (2分); (3) 减小,减小 (各1分)
(4) (2分)
(2分)

 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.