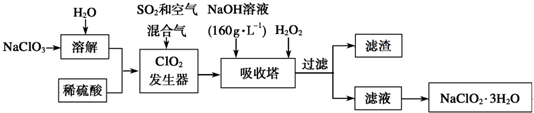
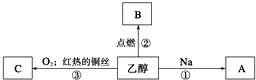
题目内容
3.同温同压下,同质量的氨气和硫化氢气体(H2S)的体积比为2:1,同温同压下,若二者氢原子数相等,它们的体积比为2:3.分析 根据n=$\frac{m}{M}$计算氨气与硫化氢的物质的量之比,同温同压下,气体的体积之比等于其物质的量之比;
同温同压下,若氨气与硫化氢含有的氢原子数相等,则二者物质的量之比为2:3,同温同压下,气体的体积之比等于其物质的量之比.
解答 解:根据n=$\frac{m}{M}$可知,同质量的氨气与硫化氢的物质的量之比为34g/mol:17g/mol=2:1,同温同压下,气体的体积之比等于其物质的量之比,故二者体积之比为2:1;
同温同压下,若氨气与硫化氢含有的氢原子数相等,则二者物质的量之比为2:3,同温同压下,气体的体积之比等于其物质的量之比,故二者体积之比为2:3,
故答案为:2:1;2:3.
点评 本题考查物质的量有关计算,比较简单,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
11.下列判断或叙述正确的是( )
| A. | 某无色溶液中加入AgNO3溶液得白色沉淀,加稀硝酸沉淀不消失,则原溶液一定存在Cl-或CO32- | |
| B. | 某无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸沉淀不溶解,则一定含有SO42- | |
| C. | 做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸 | |
| D. | 某无色溶液中滴加CaCl2溶液得白色沉淀,若加入盐酸则生成无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
18.2H2S+SO2═3S↓+2H2O的反应中,当有4×6.02×1023个电子发生转移时,得到的氧化产物比还原产物多( )
| A. | 64 g | B. | 32 g | C. | 1.5mol | D. | 3 mol |
8.下列书写或说法正确的是( )
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: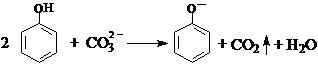 | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
15.在一定条件下,某绝热恒容密闭容器中的反应2N2O5(g)?4NO2(g)+O2(g)△H>0,达到平衡状态,下列有关该状态的说法中正确的是( )
| A. | 反应已经停止 | B. | 逆反应速率为0 | ||
| C. | 体系温度不再改变 | D. | N2O5已全部转化为NO2和O2 |
12.下列有关仪器的使用正确的是( )
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 配制480mLNaOH溶液需要的主要仪器有480mL容量瓶、玻璃棒、烧杯、量筒等 | |
| C. | 将固体药品放在蒸发皿中进行高温焙烧 | |
| D. | 冷凝管中冷却水的流向一定是下口进水、上口出水 |
19.开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料
Ⅰ、已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(1)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=-442.8kJ•mol-1.
Ⅱ、工业上采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H=Q kJ/mol
(1)下列一定能说明该可逆反应达到化学平衡状态的是(填字母序号)CD.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.混合气体的平均相对分子质量不变
(2)如表所列数据是该可逆反应在不同温度下的化学平衡常数(K).
①由表中数据判断Q<0(填“>”、“<”或“=”).
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol/L,此时对应的温度为250℃℃;CO的转化率为80%;
(3)一定温度下,将1mol CO和3molH2分别充入容积均为1L的甲(恒压)、乙(恒容)密闭容器中.若经过60s乙容器中反应达到平衡,则甲容器中达到平衡时所需的时间<60s(填“>”、“<”或“=”).
(4)要提高CO的转化率并且提高反应速率,可采取的措施是D(填字母).
A.升温 B.加入催化剂 C.增加CO的浓度
D.体积不变通入H2 E.体积不变通入惰性气体 F.分离出甲醇.
Ⅰ、已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(1)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=-442.8kJ•mol-1.
Ⅱ、工业上采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H=Q kJ/mol
(1)下列一定能说明该可逆反应达到化学平衡状态的是(填字母序号)CD.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.混合气体的平均相对分子质量不变
(2)如表所列数据是该可逆反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol/L,此时对应的温度为250℃℃;CO的转化率为80%;
(3)一定温度下,将1mol CO和3molH2分别充入容积均为1L的甲(恒压)、乙(恒容)密闭容器中.若经过60s乙容器中反应达到平衡,则甲容器中达到平衡时所需的时间<60s(填“>”、“<”或“=”).
(4)要提高CO的转化率并且提高反应速率,可采取的措施是D(填字母).
A.升温 B.加入催化剂 C.增加CO的浓度
D.体积不变通入H2 E.体积不变通入惰性气体 F.分离出甲醇.