题目内容
18.2H2S+SO2═3S↓+2H2O的反应中,当有4×6.02×1023个电子发生转移时,得到的氧化产物比还原产物多( )| A. | 64 g | B. | 32 g | C. | 1.5mol | D. | 3 mol |
分析 在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,H2S中S元素的化合价由-2升高到0,以此来解答.
解答 解:在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,为氧化剂;H2S中S元素的化合价由-2升高到0,为还原剂,则S单质既是氧化产物又是还原产物,
当有4×6.02×1023个电子发生转移时,生成3molS,即氧化产物和还原产物的和为3mol,其中H2S被氧化生成的S为2mol,SO2被还原生成的S为1mol,则氧化产物比还原产物多1mol,即32g;
故选B.
点评 本题考查氧化还原反应,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列叙述正确的是( )
| A. | 铁分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 一定条件下,铁粉与水蒸气可在高温下反应生成氢氧化铁 | |
| C. | Fe3+中的Fe2+可用KSCN溶液检验 | |
| D. | 稀硫酸不能和铜反应,但在上述混合物中加入Fe2O3 后铜能溶解 |
6.下列有关物质的分类正确的是( )
| A. | 混合物:空气、矿泉水、水银 | B. | 酸性氧化物:、CO2、SO2、CO | ||
| C. | 盐:醋酸钠、氯化铵、纯碱 | D. | 弱电解质:CH3COOH、H2O、NH3 |
13.下列实验操作中,错误的是( )
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶的支管口处 | |
| D. | 分液操作时,首先要打开分液漏斗的上口瓶塞,或使瓶塞上的凹槽与上口部的小孔对准,然后进行分液 |
10.已知乙烯醇(CH2=CHOH)不稳定,可自动转化为乙醛;二元醇可脱水生成环状化合物,现有1mol乙二醇在一定条件下脱去1mol H2O,所得产物的结构简式有下列几种,其中不可能的是( )
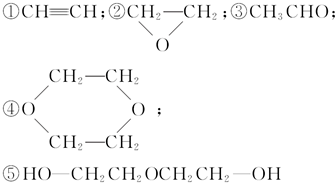

| A. | 只有① | B. | 只有①④ | C. | 只有①⑤ | D. | ①②③④⑤ |
14.在一定条件下,将3molA和1molB两种其他混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)═xC(g)+2D(s).2min 时该反应达到平衡,生成了0.8molD,并测得C的浓度为0.2mol•L-1.下列判断错误的是( )
| A. | x=1 | |
| B. | 充入稀有气体增大体系压强,可提高该反应的反应速率 | |
| C. | 平衡时A与B的转化率相等,均为40% | |
| D. | 平衡时B与C的浓度之比为3:2 |