题目内容
13.氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸(不稳定且有毒):Cl2+H2O?HCl+HClO K=4.5×10-4
(1)氯碱工业生产氯气的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑.
(2)使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度低,且随着HClO的消耗,平衡会不断正向移动,补充HClO.
(3)亚氯酸钠(NaClO2)是一种新型的含氯消毒剂,利用过氧化氢和二氧化氯在碱性条件下生产亚氯酸钠的工艺流程图:
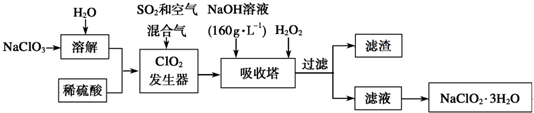
已知:
Ⅰ.NaClO2的溶解度随温度升高而增大;
Ⅱ.纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全.
请回答:
①每生成1mol ClO2需要SO2的物质的量是0.5mol;
②吸收塔内发生反应的化学方程式为2ClO2+H2O2+2NaOH═2NaClO2+O2+2H2O;
③吸收塔的温度不能超过20℃,目的之一是防止H2O2分解.吸收塔排出的浊液经过滤,滤渣的主要成份是Na2SO4晶体.
分析 (1)电解饱和食盐水制备氯气;
(2)使用氯气为自来水消毒可以有效地控制次氯酸的浓度,因氯气与水的反应为可逆反应,反应限度小;
(3)由流程可知,溶解后,ClO2发生器中目的是产生ClO2,二氧化硫具有还原性,将ClO3-还原为ClO2,自身被氧化为SO42-,反应离子方程式为2SO2+4ClO3-=4ClO2+2SO42-;吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,Cl元素的化合价降低,被还原,则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,吸收塔中应维持NaOH稍过量,以此来解答.
解答 解:(1)氯碱工业生产氯气的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)使用氯气为自来水消毒可以有效地控制次氯酸的浓度,结合平衡常数解释原因为由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO 浓度低,且随着HClO的消耗,平衡会不断正向移动,补充HClO,
故答案为:由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO 浓度低,且随着HClO的消耗,平衡会不断正向移动,补充HClO;
(3)由流程可知,溶解后,ClO2发生器中目的是产生ClO2,二氧化硫具有还原性,将ClO3-还原为ClO2,自身被氧化为SO42-,反应离子方程式为2SO2+4ClO3-=4ClO2+2SO42-;吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,Cl元素的化合价降低,被还原,则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.
①由2SO2+4ClO3-=4ClO2+2SO42-可知,每生成1mol ClO2需要SO2的物质的量是1mol×$\frac{2}{4}$=0.5 mol,故答案为:0.5mol;
②由上述分析可知,吸收塔内发生反应的化学方程式为2ClO2+H2O2+2NaOH═2NaClO2+O2+2H2O,故答案为:2ClO2+H2O2+2NaOH═2NaClO2+O2+2H2O;
③吸收塔的温度不能超过20℃,目的之一是防止H2O2分解.吸收塔排出的浊液中含钠离子、硫酸根离子,经过滤,滤渣的主要成份是Na2SO4晶体,故答案为:Na2SO4晶体.
点评 本题考查制备实验方案的设计,为高频考点,把握氯碱工业及生产亚氯酸钠的工艺流程图为解答的关键,注意流程中发生的反应,侧重分析与实验能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | C1=C2 | B. | C1>C2 | C. | C1<C2 | D. | 无法确定 |
| A. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| B. | 为了使养分还田而将植物秸秆焚烧处理 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| D. | 实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
| A. | 铁分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 一定条件下,铁粉与水蒸气可在高温下反应生成氢氧化铁 | |
| C. | Fe3+中的Fe2+可用KSCN溶液检验 | |
| D. | 稀硫酸不能和铜反应,但在上述混合物中加入Fe2O3 后铜能溶解 |
| A. | 过滤时玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时漏斗下方紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 加热氯酸钾制取氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 |
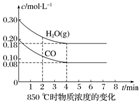 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.该反应的Q<0(填“>”或“<”).
(2)850℃时在体积为10L的反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的物质的量浓度变化如图所示,则0~4min时平均反应速率v(CO)=0.03mol/(L•min).
(3)若在500℃时进行.且CO、H2O(g)的起始浓度均为0.020mol•L-1,该条件下,CO的最大转化率为75%.
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中H2O(g)的体积分数为x,平衡时CO的转化率为y,试推导y与x之间的关系x=y.