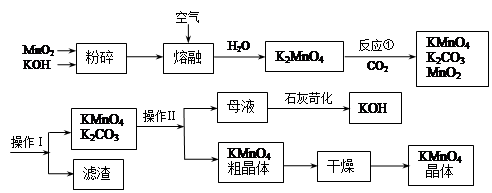
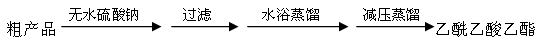题目内容
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
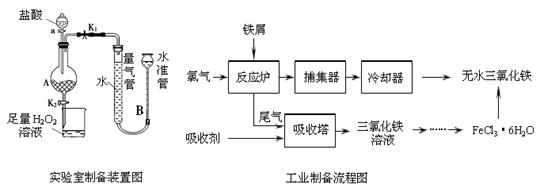
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2) 废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
实验室制备操作步骤如下:
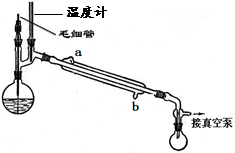
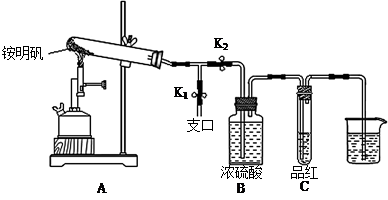
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
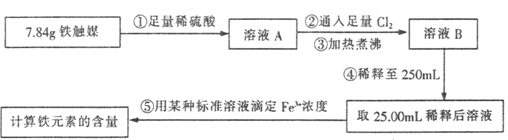
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl3?6H2O晶体的操作步骤是:加入 _ 后、 _ 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol?L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是: _
②样品中氯化铁的质量分数 _

已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2) 废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl3?6H2O晶体的操作步骤是:加入 _ 后、 _ 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol?L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是: _
②样品中氯化铁的质量分数 _
(1)把亚铁离子全部氧化成三价铁离子 (2分)
(2)装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分)(2分)
(3)盐酸(1分) 蒸发浓缩、冷却结晶(1分)
(4)2Fe2+ + Cl2 = 2Fe3+ (2分)
(5)Fe2Cl6(2分)
(6)① 溶液由蓝色变无色,且半分钟内不变色(2分)
② (2分)
(2分)
(2)装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分)(2分)
(3)盐酸(1分) 蒸发浓缩、冷却结晶(1分)
(4)2Fe2+ + Cl2 = 2Fe3+ (2分)
(5)Fe2Cl6(2分)
(6)① 溶液由蓝色变无色,且半分钟内不变色(2分)
②
 (2分)
(2分)试题分析:(1)根据实验装置和操作步骤可知,实验室制备无水FeCl3,是利用铁与盐酸反应生成FeCl2,然后把FeCl2氧化成FeCl3,先制得FeCl3·6H2O晶体,再脱结晶水制得无水FeCl3。烧杯中足量的H2O2溶液是作氧化剂,把亚铁离子全部氧化成三价铁离子;
(2)铁与盐酸反应完全时,不再产生氢气,所以装置A中不产生气泡或量气管和水准管的液面不再变化,此时,可将A中FeCl2溶液放入烧杯中进行氧化。
(3)从FeCl3溶液制得FeCl3?6H2O晶体的操作步骤是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)从工业制备流程图分析可知,反应炉中进行的反应是 2Fe + 3Cl2 = 2FeCl3,因此,进入吸收塔中的尾气是没有参加反应的氯气,在吸收塔中氯气被吸收剂吸收,反应后生成2FeCl3溶液,所以吸收剂应是2FeCl2溶液,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+。
(5)捕集器收集的是气态FeCl3,FeCl3的相对分子质量是162.5,由相对分子质量为325的铁的氯化物可以推出,当温度超过673 K时,二分子气态FeCl3可以聚合生成双聚体Fe2Cl6。(备注:FeCl3属共价型化合物,能溶于乙醚、丙酮等有机溶剂,在673K蒸气中有双聚体,1023K以上分解为单分子)。
(6)①称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,此时溶液呈蓝色,用 Na2S2O3溶液滴定,滴入最后一滴Na2S2O3溶液,锥形瓶内的溶液由蓝色变为无色,且半分钟内不变色。所以滴定终点的现象是:溶液由蓝色变为无色,且半分钟内不变色。
② 求样品中氯化铁的质量分数
由反应:2Fe3+ + 2I - = 2Fe2+ + I2; I2+2S2O32-═2I-+S4O62-;可得关系式:
2Fe3+ — I2 — 2S2O32-
1 1
n cV×10-3
求得n(Fe3+) = cV×10-3 mol, 则样品中氯化铁的质量分数为:
ω(Fe3+) = cV×10-3 mol×10×162.5g/mol×100% =
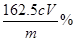

练习册系列答案
相关题目
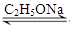 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下: