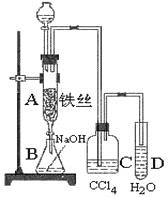
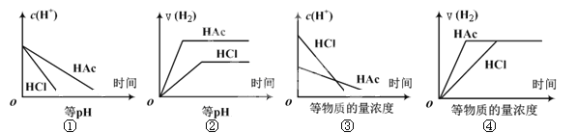
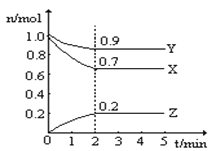
题目内容
【题目】周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm);F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。根据题意请回答下列问题:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
(1)B的原子结构示意图为___________。
(2)F2C和F2E两种化合物中,沸点较高的是____(填化学式)。
(3)用电子式表示化合物H2E的形成过程_______________________________。
(4)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质为KOH。 则该电池的负极的电极反应式为__________________________________。
【答案】 ![]() H2O
H2O ![]() CH4+10OH-―8e-=CO32-+7H2O
CH4+10OH-―8e-=CO32-+7H2O
【解析】根据元素的主要化合价和原子半径可知,A是N元素,B是Al元素,C是S属于,D是氯元素,E是氧元素。F原子中无中子,所以F是氢元素。G在地壳中含量居第二位,则G是硅元素。H元素焰色反应呈紫色,则H是K元素。
(1)B的原子结构示意图为![]() ;(2)由于水分子间能形成氢键,所以水分子的沸点高于H2S的沸点;(3)氧化钾是离子化合物,其形成过程可表示为
;(2)由于水分子间能形成氢键,所以水分子的沸点高于H2S的沸点;(3)氧化钾是离子化合物,其形成过程可表示为![]() ;(7)原电池中负极失去电子,则甲烷在负极通入电极反应式是CH4+10OH-―8e-=CO32-+7H2O。
;(7)原电池中负极失去电子,则甲烷在负极通入电极反应式是CH4+10OH-―8e-=CO32-+7H2O。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目