题目内容
【题目】Ⅰ.某温度下,子一个10L的恒容密闭容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
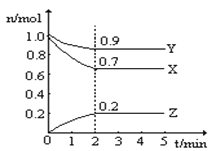
(1)该反应的化学方程式为_____________ ;
(2)反应开始至2min,以气体Z表示的平均反应速率为_____________;
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:
①混合气体的压强②混合气体的密度③混合气体的总物质的量④混合气体的颜色⑤混合气体的平均相对分子质量⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明A(s)+2B(g) ![]() C(g)+D(g)达到平衡状态的是_______。
C(g)+D(g)达到平衡状态的是_______。
Ⅲ. 将 6mol A气体 与 2mol B气体在2L密闭容器中混合并在一定条件下发生反应:
3A(g)+B(g)![]() xC(g)+2D(g).若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L·min),请填写下列空白:
xC(g)+2D(g).若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L·min),请填写下列空白:
①x的数值为______;
②5min时B的转化率为______;
③若升高温度,V逆_________(填“变大”“变小”或“相等”)。
【答案】 3X+Y![]() Z 0.01mol/(L·min) ①③⑤ ②⑤ 1 50% 变大
Z 0.01mol/(L·min) ①③⑤ ②⑤ 1 50% 变大
【解析】(1)由图知,X、Y的物质的量分别减少0.3mol、0.1mol,说明X、Y是反应物;Z的物质的量增加0.2mol,Z是生成物;根据化学方程式中各物质的物质的量的改变量之比等于化学计量数之比,所以该反应的化学方程式为3X+Y ![]() 2Z;(2)反应开始至2 min,气体Z的浓度增大
2Z;(2)反应开始至2 min,气体Z的浓度增大![]() =0.02mol/L,
=0.02mol/L, ![]() =
=![]() =
= ![]() =0.01 mol/(L·min);
=0.01 mol/(L·min);
Ⅱ. (1)对于反应2SO2(g)+O2(g) ![]() 2SO3(g):①正反应是气体体积缩小的方向,若混合气体的压强不变,则气体的总量不变,反应达到平衡状态;②反应在恒容容器中进行,且反应物都为气体,混合气体的密度始终不变,密度不变不一定达到平衡状态;④反应物都为无色气体,混合气体的颜色始终不变,颜色不变不一定达到平衡状态;⑤根据
2SO3(g):①正反应是气体体积缩小的方向,若混合气体的压强不变,则气体的总量不变,反应达到平衡状态;②反应在恒容容器中进行,且反应物都为气体,混合气体的密度始终不变,密度不变不一定达到平衡状态;④反应物都为无色气体,混合气体的颜色始终不变,颜色不变不一定达到平衡状态;⑤根据![]() =
=![]() ,反应气体总质量始终不变,若混合气体的平均相对分子质量不变,则总物质的量不变,则可以证明达平衡状态;⑥反应进行都是按各反应物或生成物的反应速率之比等于化学计量数之比,与是否达到平衡状态无关;因此答案为①③⑤;(2)反应A(s)+2B(g)
,反应气体总质量始终不变,若混合气体的平均相对分子质量不变,则总物质的量不变,则可以证明达平衡状态;⑥反应进行都是按各反应物或生成物的反应速率之比等于化学计量数之比,与是否达到平衡状态无关;因此答案为①③⑤;(2)反应A(s)+2B(g) ![]() C(g)+D(g)为气体体积不变的反应。①混合气体的压强始不变,压强不变反应不一定达到平衡状态;②反应在恒容容器中进行,且反应物A为固体,混合气体的密度随A的变化而变化,密度不变说明达到平衡状态;④反应物颜色不明,颜色不一定达到平衡状态;⑤根据
C(g)+D(g)为气体体积不变的反应。①混合气体的压强始不变,压强不变反应不一定达到平衡状态;②反应在恒容容器中进行,且反应物A为固体,混合气体的密度随A的变化而变化,密度不变说明达到平衡状态;④反应物颜色不明,颜色不一定达到平衡状态;⑤根据![]() =
=![]() ,反应气体总质量随A的变化而变化,而总物质的量不变,若混合气体的平均相对分子质量不变,则气体总质量不变,A的量不变,则达平衡状态;⑥反应进行都是按各反应物或生成物的反应速率之比等于化学计量数之比,与是否达到平衡状态无关;因此答案为②⑤;
,反应气体总质量随A的变化而变化,而总物质的量不变,若混合气体的平均相对分子质量不变,则气体总质量不变,A的量不变,则达平衡状态;⑥反应进行都是按各反应物或生成物的反应速率之比等于化学计量数之比,与是否达到平衡状态无关;因此答案为②⑤;
Ⅲ.①达到平衡时,容器内的压强变小,所以x+2<3+1,且x为整数,所以x=1;
平衡时,生成的D的物质的量为 0.2mol/(L﹒min)×5min×2L=2mol,
根据三段式解题法,
3A(g)+B(g)![]() C(g)+2D(g),
C(g)+2D(g),
开始(mol):6 2 0 0
变化(mol):3 1 1 2
平衡(mol):3 1 1 2
②B的转化率为![]() ×100%=50%;
×100%=50%;
③升高温度,无论正反应速率还是逆反应速率都增大,故V逆变大。

 阅读快车系列答案
阅读快车系列答案【题目】周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm);F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。根据题意请回答下列问题:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
(1)B的原子结构示意图为___________。
(2)F2C和F2E两种化合物中,沸点较高的是____(填化学式)。
(3)用电子式表示化合物H2E的形成过程_______________________________。
(4)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质为KOH。 则该电池的负极的电极反应式为__________________________________。