题目内容
【题目】分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是 ( )
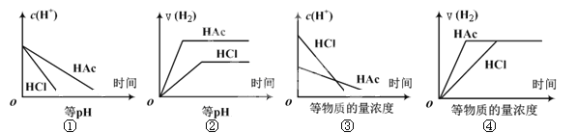
A. ①②③ B. ②④ C. ①③ D. ①②③④
【答案】A
【解析】试题分析:①随着反应的进行,氢离子浓度逐渐减小但是醋酸会逐渐电离出氢离子,所以醋酸中氢离子消耗的速率慢,正确;②等pH时,醋酸浓度较大,加入足量锌,不仅产生的氢气的体积更大,而且反应更快,正确;③等浓度的盐酸和醋酸,盐酸的pH小,和金属锌反应的速率比醋酸的快正确;④等浓度的盐酸和醋酸,因为盐酸是强酸,醋酸是弱酸,盐酸中H+浓度大,和金属锌反应的速率是盐酸比醋酸的快,错误,故A项正确。

练习册系列答案
相关题目
【题目】周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm);F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。根据题意请回答下列问题:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
(1)B的原子结构示意图为___________。
(2)F2C和F2E两种化合物中,沸点较高的是____(填化学式)。
(3)用电子式表示化合物H2E的形成过程_______________________________。
(4)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质为KOH。 则该电池的负极的电极反应式为__________________________________。