题目内容
8.在下列反应中,盐酸作氧化剂的是( )| A. | NaOH+HCl=NaCl+H2O | |
| B. | Zn+2HCl=ZnCl2+H2 | |
| C. | BaCO3+2HCl=BaCl2+H2O+CO2↑ | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O |
分析 盐酸在下列反应中作氧化剂,H元素化合价降低,应生成氢气,以此解答该题.
解答 解:A.元素化合价没有发生变化,不是氧化还原反应,故A错误;
B.H元素化合价降低,被还原,盐酸为氧化剂,故B正确;
C.元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.Cl元素化合价升高,被氧化,HCl为还原剂,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力和概念的理解的考查,难度不大,注意从元素化合价变化的角度认识相关概念和物质的性质.

练习册系列答案
相关题目
16.有机物X的结构简式为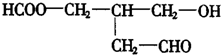 若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
①酯化 ②水解 ③氧化 ④还原 ⑤消去.
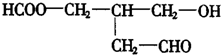 若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
若使X通过化学变化,失去光学活性,可能发生的反应类型有( )①酯化 ②水解 ③氧化 ④还原 ⑤消去.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ③④⑤ | D. | ②③④⑤ |
3.下列反应中,属于取代反应的是( )
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 甲烷与氯气混合,光照后黄绿色变浅 | |
| D. | 乙烯使溴的四氯化碳溶液褪色 |
13.实验中需2mol•L-1的Na2CO3溶液950mL,配制时应称取Na2CO3的质量分别是( )
| A. | 212g | B. | 543.4g | C. | 572g | D. | 286g |
20.理化知识中有很多的“相等”.请你判断下列说法中不正确的是( )
| A. | 100体积的水和100体积的酒精混合,所得混合溶液的体积等于200体积 | |
| B. | 串联电路中电流大小处处相等 | |
| C. | 稀盐酸和氢氧化钠溶液混合后,所得溶液质量与反应前溶液的总质量相等 | |
| D. | 在化学反应中,反应物的原子种类和总数等于生成物的原子种类和总数 |
17.下列物质中,既有共价键又有离子键的是( )
| A. | MgCl2 | B. | O2 | C. | NaOH | D. | H2S |
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.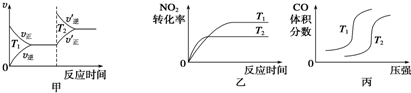
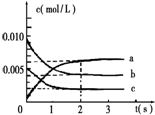
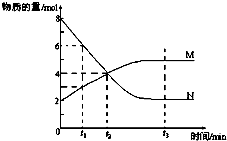 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: M.
M.