题目内容
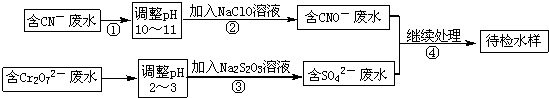
18.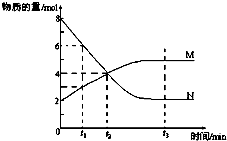 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:(1)该反应的化学方程式是2N
 M.
M.(2)在图上所示的三个时刻中,t3(填t1、t2或t3)时刻达到化学反应限度.
分析 (1)根据物质的量的变化与化学计量数呈正比书写化学方程式;
(2)根据曲线的变化判断达到平衡状态的时间,根据平衡状态的特征判断反应速率之间的关系;
解答 解:(1)由图象看出反应从开始到平衡,N的物质的量减小,应为反应物,物质的量变化值为8mol-2mol=6mol,
M的物质的量增多,应为是生成物,物质的量的变化值为5mol-2mol=3mol,
根据物质的量的变化与化学计量数呈正比,
则有n(N):n(M)=6mol:3mol=2:1,所以反应的化学方程式为2N M,
M,
故答案为:2N M;
M;
(2)达到平衡状态时,各物质的物质的量不再发生变化,由曲线的变化可知t3时刻处于平衡状态,此时正逆反应速率相等,故答案为:t3;
点评 本题考查化学反应速率的影响因素,题目难度不大,注意对图象的分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.在下列反应中,盐酸作氧化剂的是( )
| A. | NaOH+HCl=NaCl+H2O | |
| B. | Zn+2HCl=ZnCl2+H2 | |
| C. | BaCO3+2HCl=BaCl2+H2O+CO2↑ | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O |
9.下列物质中,含有极性键的是( )
| A. | 单质碘 | B. | 氯化镁 | C. | 溴化钾 | D. | 水 |
13.氢气在氧气中燃烧时产生淡蓝色火焰.在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol O2中的化学键消耗的能量为Q2 kJ,形成1mol H2O中的化学键释放的能量为Q3 kJ.下列关系式中,正确的是( )
| A. | Q1+Q2>Q3 | B. | 2Q1+Q2>2Q3 | C. | 2Q1+Q2<2Q3 | D. | Q1+Q2<2Q3 |
3.三氟化氮(NH3)是一种无色无味的气味,它是氨气(NH3)和氟(F2)在一定条件下发生反应4NH3+3F2═NF3+3NH4F得到的.下列关于NF3的叙述正确的是( )
| A. | NF3中N呈+3价 | B. | NF3的还原性比NH3强 | ||
| C. | NF3的氧化性比F2强 | D. | NF3是离子化合物 |
10.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- |
7.下列说法正确的是( )
| A. | 摩尔是表示物质所含质量多少的单位 | |
| B. | 摩尔质量就等于物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等 |
 .
. .
.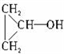 .
.