题目内容
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )

A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
【答案】D
【解析】
A. CH3COOH溶液与0.1molNaOH固体混合,CH3COOH+NaOH![]() CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,其中CH3COONa的水解促进水的电离,CH3COOH的电离抑制水的电离。若向该混合溶液中通入HCl,c点反应CH3COONa+HCl
CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,其中CH3COONa的水解促进水的电离,CH3COOH的电离抑制水的电离。若向该混合溶液中通入HCl,c点反应CH3COONa+HCl![]() CH3COOH+NaCl恰好完全发生,CH3COONa减少,CH3COOH增多;若向该混合溶液中加入NaOH 固体,a点反应CH3COOH+NaOH
CH3COOH+NaCl恰好完全发生,CH3COONa减少,CH3COOH增多;若向该混合溶液中加入NaOH 固体,a点反应CH3COOH+NaOH![]() CH3COONa+H2O恰好完全进行,CH3COONa增多,CH3COOH减少,因此,水的电离程度: a>b>c,故A正确;
CH3COONa+H2O恰好完全进行,CH3COONa增多,CH3COOH减少,因此,水的电离程度: a>b>c,故A正确;
B.CH3COOH溶液与0.1molNaOH固体混合,CH3COOH+NaOH![]() CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,b点溶液呈酸性,说明CH3COOH浓度远大于CH3COONa,c点CH3COONa与HCl反应完全,溶液呈酸性,此时溶液为CH3COOH和NaCl溶液,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;
CH3COONa+H2O,形成CH3COOH和CH3COONa的混合溶液,b点溶液呈酸性,说明CH3COOH浓度远大于CH3COONa,c点CH3COONa与HCl反应完全,溶液呈酸性,此时溶液为CH3COOH和NaCl溶液,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;
C.a点反应CH3COOH+NaOH![]() CH3COONa+H2O恰好完全进行,溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),此时pH=7,则c(H+)= c(OH-),则c(Na+)= c(CH3COO-),故C正确;
CH3COONa+H2O恰好完全进行,溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),此时pH=7,则c(H+)= c(OH-),则c(Na+)= c(CH3COO-),故C正确;
D. 该温度下pH=7时,c(H+)=10-7mol·L-1,c(CH3COO-)=c(Na+)=0.2mol/L,c(CH3COOH)=(c-0.2)mol/L,则醋酸的电离平衡常数Ka=![]() =
=![]() ,故D错误;
,故D错误;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】“一碳化学”是指以含一个碳原子的化合物(如CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) H1
NH2COONH4(s) H1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
请回答下列问题:
①反应I的H1=__kJ/mol。
②反应II一般在__(填“高温或“低温")条件下有利于该反应的进行。
③一定温度下,在体积固定的密闭容器中按计量比投料进行反应I,下列能说明反应达到了平衡状态的是__(填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)将CO2和H2按物质的量之比为1:3充入一定体积的密闭容器中,发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H。测得CH3OH的物质的量在不同温度下随时间的变化关系如图所示。
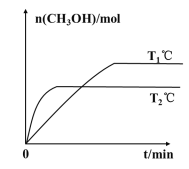
①根据图示判断H__0(填“>”或“<”)。
②一定温度下,在容积均为2L的两个密闭容器中,按如下方式加入反应物,10min后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmolCH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的0.8倍,则反应10min内甲容器中以CH3OH(g)表示的化学反应速率为__,此温度下的化学平衡常数为__(保留两位小数);要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为__。
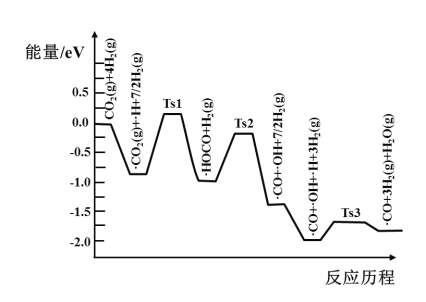
(3)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。