题目内容
7.比较下列几种溶液混合后各离子浓度的大小.(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(2)NaOH和CH3COOH等浓度按1:2体积比混合后pH<7,离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(3)pH=2的CH3COOH与pH=12的NaOH等体积混合,其离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
分析 (1)将等体积等浓度的CH3COOH和NaOH溶液混合,反应后溶质为醋酸钠,醋酸根离子部分水解,溶液显示碱性,结合电荷守恒判断醋酸钠溶液中各离子浓度大小;
(2)NaOH和CH3COOH等浓度按1:2体积比混合后得到溶液中溶质为等浓度的CH3COOH和CH3COONa的混合溶液,pH<7,说明电离大于水解,据此书写离子浓度大小;
(3)醋酸为弱酸,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性,则c(H+)>c(OH-),然后根据电荷守恒判断溶液中离子浓度大小.
解答 解:(1)将等体积等浓度的CH3COOH和NaOH溶液混合,反应后溶质为醋酸钠,醋酸根离子部分水解,溶液显示碱性,则c(OH-)>cc(H+),根据电荷守恒可得:c(Na+)>c(CH3COO-),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)NaOH和CH3COOH等浓度按1:2体积比混合后得到溶液中溶质为等浓度的CH3COOH和CH3COONa的混合溶液,pH<7,说明电离大于水解,据此书写离子浓度大小,溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3)醋酸为弱电解质,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可得:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意掌握电荷守恒、物料守恒、质子守恒的含义,明确盐的水解原理及其应用,能够根据盐的水解原理及各守恒关系正确判断溶液中离子浓度大小.

 优生乐园系列答案
优生乐园系列答案| A. | 小苏打溶液与乙酸溶液混合 HCO${\;}_{3}^{-}$+CH3COOH═CH3COO-+H2O+CO2↑ | |
| B. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| C. | Fe2O3溶于HI溶液中 Fe2O3+6H++2I-═2Fe2++3H2O+I2 | |
| D. | 过量CO2通入NaAlO2溶液中:2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO2${\;}_{3}^{-}$ |
| 正 极 | 负 极 | 电解质溶液 | |
| A | Cu | Fe | FeCl3 |
| B | C | Fe | Fe(NO3)3 |
| C | Fe | Zn | Fe2(SO4)3 |
| D | Ag | Fe | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 聚合物的链节是(如图2) | |
| B. | 聚合物的分子式是(C3H3Cl3)n | |
| C. | 聚合物的单体是CHCl=CHCl | |
| D. | 若n为聚合度,则其相对分子质量为97n |
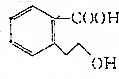 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | M的分子式为C9H10O3 | |
| B. | M 可使酸性KMnO4溶液褪色 | |
| C. | 1 mol M完全燃烧消耗10 mol O2 | |
| D. | 1 mol M能与足量Na反应生成0.5 mol H2 |
| A. | 配合物的外界是指配合物中的阴离子 | |
| B. | 只有过渡金属元素能形成配合物 | |
| C. | Fe(SCN)3不属于配合物 | |
| D. | Na3[AlF6]的中心原子的配位数为6 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1