题目内容
19.某有机物M的结构简式为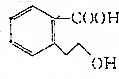 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | M的分子式为C9H10O3 | |
| B. | M 可使酸性KMnO4溶液褪色 | |
| C. | 1 mol M完全燃烧消耗10 mol O2 | |
| D. | 1 mol M能与足量Na反应生成0.5 mol H2 |
分析 A、根据M的结构简式可知,M的分子式为C9H10O3;
B、醇能被高锰酸钾氧化;
C、根据M的分子式可知完全燃烧消耗的氧气的物质的量;
D、羧基、羟基都能与钠反应产生氢气;
解答 解:A、根据M的结构简式可知,M的分子式为C9H10O3,故A正确;
B、醇能被高锰酸钾氧化,所以醇可使酸性KMnO4溶液褪色,故B正确;
C、根据M的分子式C9H10O3可知完全燃烧1 mol M完全燃烧消耗10mol O2消耗的氧气的物质的量,故C正确;
D、羧基、羟基都能与钠反应产生氢气,所以1 mol M能与足量Na反应生成1 mol H2,故D错误;
故选ABC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,题目难度不大.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
10.有一种有机物结构简式为:HOCH2-CH=CHCH2COOCH2CH3,推测它不可能具有下列哪种性质( )
| A. | 常温下,能被酸性高锰酸钾溶液氧化 | |
| B. | 该分子最少有4个碳原子共平面 | |
| C. | 常温下,能在碱性条件下发生水解反应 | |
| D. | 常温下,能够与碳酸钠溶液反应生成CO2 |
14. 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )| A. | 2.19n g | B. | 2.19g | C. | $\frac{2.92}{n}$g | D. | 2.92g |
9.下列叙述正确的是( )
| A. | 实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 | |
| B. | SO3溶于水能导电,但它是非电解质 | |
| C. | 有单质参加同时有单质生成的反应一定属于氧化还原反应 | |
| D. | 不与酸反应的氧化物一定会跟碱反应 |